真實世界證據支持藥物(wù)研發與審評的(de)
指導原則(試行(xíng))
一(yī)、引言
(一(yī))背景與目的(de)
随機(jī)對(duì)照(zhào)試驗(Randomized Controlled Trial,RCT)一(yī×)般被認為(wèi)是(shì)評價藥物(wù)安全性和(hé)有(yǒu)效性的(de)金(jīn)标準,并為(w✔èi)藥物(wù)臨床研究普遍采用(yòng)。RCT嚴格控制(zhì)試驗入組、排除标準和(hé)其它條件₹(jiàn),并進行(xíng)随機(jī)化(huà)分(fēn)組,因此能(néng)夠最大(dà)限度地(dì)減少(shǎo)其它因素對(duì)療效估計(jì)的(de)影(yǐng)響÷,使得(de)研究結論較為(wèi)确定,所形成的(de)證據可(kě)靠性較高(gāo)。但(dàn)RCT有(yǒu)其局限性:一(yī)是(shì)RCT的(de)研究結論外(wài)推于臨床±實際應用(yòng)時(shí)面臨挑戰,如(rú)嚴苛的(de)入排标準使得(de)試驗人(rén)群不(bù)能(néng)充分(fēn)代表目标人(rén)群,所采用(yòng)的(de)标準幹預與臨床實踐不(bù)完全一(yī)緻,有(yǒu)限的(de)$樣本量和(hé)較短(duǎn)的(de)随訪時(shí)間(jiān)導緻對(duì)罕見(jiàn)不(bù)良事(shì)件(jiàn)探測不(bù)足等;二是(shì)對(duì)于某些(λxiē)疾病領域,傳統RCT難以實施,如(rú)某些(xiē)缺乏有(yǒu)效治療措施的(de)罕見(jiàn)病和(hé)危及生(shēng)命的(de)重大(dà)疾病;三是(shì)傳統RCT或需高(gāo)昂的(de)時(shí)間(jiān)成本。因此,在藥物(wù)研發和( hé)監管領域如(rú)何利用(yòng)真實世界證據(Real World Evidence,RWE)評價藥物(wù)的(d∏e)有(yǒu)效性和(hé)安全性,已成為(wèi)全球相(xiàng)關監管機(jī)構、制(zhì)藥工(gōng)業(yè)界和(hé)學術(shù)界共同關注且♠具有(yǒu)挑戰性的(de)問(wèn)題。
一(yī)是(shì)需要(yào)從(cóng)概念上(shàng)厘清真實世界證據的(de)定義、範疇和(hé)內(nèi)涵。
二是(shì)真實世界數(shù)據(Real World Data,RWD)是(shì)否适用(yòng)于回答(dá)臨床所關注的(de)科(kē)學問(wèn)題,所生(shēng)成的(∑de)真實世界證據能(néng)否或如(rú)何起到(dào)充分(fēn)的(de)支撐作(zuò)用(yòng),涉及諸多(duō)亟待商榷和(hé)解決的γ(de)問(wèn)題,包括數(shù)據來(lái)源、數(shù)據标準、數(shù)據質量、數(shù)據共享、數(shù)據的(de☆)基礎建設等,也(yě)對(duì)指南(nán)的(de)制(zhì)定提出了(le)迫切需求。
三是(shì)利用(yòng)真實世界數(shù)據的(de)方法學有(yǒu)待規範。真實世界證據源于對(duì)真實世界數(shù)據的(de)正确和(hé)充分(fēn)分(fēn$)析,所采用(yòng)的(de)分(fēn)析方法主要(yào)是(shì)因果推斷方法,涉及較複雜(zλá)的(de)模型、假設甚至人(rén)工(gōng)智能(néng)和(hé)機(jī)器(qì)學習(xí)方法的(de)應用(yòng)等,對(duì)相(xiàng)關人(rén)員(yuá&n)提出了(le)更高(gāo)的(de)要(yào)求。
四是(shì)真實世界證據的(de)适用(yòng)範圍有(yǒu)待明(míng)确。真實世界證據與傳統RCT提供的(de)證據均"可(kě)以是(shì)藥物(wù)監管決策證據的(de)組成部分(fēn),支持監管決策形成綜合、完整而嚴謹的(de)證據鏈,從(cóng)而提高(gāo)藥物(wù)研發和(hé)監管的(de≈)科(kē)學性和(hé)效率。因此,需要(yào)根據藥物(wù)研發和(hé)監管的(de)現(xiàn)實情況明(míng)确真實世β界證據的(de)适用(yòng)範圍,并能(néng)夠随現(xiàn)實情況變化(huà)進行(xíng)調整。
鑒于上(shàng)述情況,本指南(nán)旨在厘清藥物(wù)研發和(hé)監管決策中真實世界證據的(de)相(xiàng)關定義,指導真實世界數₹(shù)據收集以及适用(yòng)性評估,明(míng)确真實世界證據在藥物(wù)監管決策中的(de)地(dì)☆位和(hé)适用(yòng)範圍,探究真實世界證據的(de)評價原則,為(wèi)工(gōng)業(yè)界和(hé)監管部門(mén≤)利用(yòng)真實世界證據支持藥物(wù)監管決策提供參考意見(jiàn)。本指導原則僅代表當前的(de)觀點和(hé)認識,随著(₹zhe)研究和(hé)認識的(de)深入将不(bù)斷修訂和(hé)完善。
(二)國(guó)內(nèi)外(wài)監管機(jī)構在法規或指南(nán)制(zhì)定方面的(de)進展
2009年(nián)美(měi)國(guó)複蘇與再投資法案對(duì)實效比較研究(Comparative Effec$tiveness Research,CER)起到(dào)了(le)巨大(dà)推動作(zuò)用(yòng)。基于CER的(de)真實世界環境的±(de)背景,真實世界研究(Real World Research/Study,RWR/RWS)得(de)以更廣泛的(de)應用(yòng)Ω。
美(měi)國(guó)于2016年(nián)12月(yuè)通(tōng)過《21世紀治愈法案》,®鼓勵美(měi)國(guó)食品藥品監督管理(lǐ)局(The Food and Drug Administration,FDA)開(kāi)展研究并使用(yòng)真實世界證據支持藥δ物(wù)和(hé)其它醫(yī)療産品的(de)監管決策,加快(kuài)醫(yī)藥産品開(kā✘i)發。在該法案的(de)推動下(xià),2017-2019年(nián)FDA先後發布了(le)←《使用(yòng)真實世界證據支持醫(yī)療器(qì)械監管決策》《臨床研究中使用(yòng)電(diàn)子(zǐ)健康檔案 數(shù)據指南(nán)》《真實世界證據計(jì)劃的(de)框架》和(hé)《使用(yòng)真實世界數(shù)據和(hé)真實世界證據向FDA遞交藥物(wù)和(hé)生(shēng )物(wù)制(zhì)品資料》。
歐盟藥品管理(lǐ)局(EuropeanMedicines Agency,EMA)于2013年(nián)參與的(de)∞GetRealInitiative項目,緻力于開(kāi)發出收集與綜合RWE的(de)新方法,以便更早地(dì)用(yòng)于藥品研發和(hé)醫(yī)療保健決策過程中。EMA于2014年(nián)啓動了(le)适應性許可(kě)試點項目,探索利用(yòng)真實世界數(shù)據包括觀察性研究數(shù)據等用(y òng)于監管決策的(de)可(kě)行(xíng)性。2017年(nián)藥品局總部(Heads ofMedicines Agenciesσ,HMA)與EMA聯合成立大(dà)數(shù)據工(gōng)作(zuò)組,旨在使用(yòng)大(d₩à)數(shù)據改進監管決策并提高(gāo)證據标準,其中RWE是(shì)大(dà)數(shù)據的(d≈e)一(yī)個(gè)子(zǐ)集,包括電(diàn)子(zǐ)健康檔案、登記系統、醫(yī)院記錄和(hé)健康保險等數(shù)據。
日(rì)本藥品和(hé)醫(yī)療器(qì)械管理(lǐ)局(PMDA)在國(guó)際人(rén)用(yòng)藥品注冊技(jì∞)術(shù)要(yào)求協調會(huì)(International Council for Harmonisation ofTechnical Requirem≥ents for Pharmaceuticals for Human Use,ICH)層面提出更高(gāo)效利用(yòng)真實世界數(shù)據開(kāi)展上☆(shàng)市(shì)後藥物(wù)流行(xíng)病學研究的(de)技(jì)術(shù)要(yào)求新議(yβì)題。
事(shì)實上(shàng),全球使用(yòng)真實世界數(shù)據對(duì)醫(yī)療産品進行(xíng)安全性評✔價已經積累了(le)豐富的(de)實踐經驗,例如(rú)2008年(nián)美(měi)國(guó)FDA啓動了(le)哨點計(jì)劃,利用(yòng)≈現(xiàn)有(yǒu)的(de)電(diàn)子(zǐ)醫(yī)療健康數(shù)據實現(xiàn)對(duì)上(shàng)市(shì)後•醫(yī)療産品安全性的(de)主動監測。
我國(guó)系統性開(kāi)展使用(yòng)真實世界證據支持藥物(wù)監管決策的(de)工(gōng)作(zuò)尚處于起步階段。國(guó)家(jiā)藥品監管部門(mén)在審評審批實踐中開(kāi)始應用(yòng)真實世界證據,相•(xiàng)關示例參見(jiàn)附2。
二、真實世界研究的(de)相(xiàng)關定義
真實世界研究是(shì)指針對(duì)預設的(de)臨床問(wèn)題,在真實世界環境下(xià)收集與研究對(duì)象健康有(yǒu)關的(de)數(shù)據≠(真實世界數(shù)據)或基于這(zhè)些(xiē)數(shù)據衍生(shēng)的(de)彙總數(shù)據♦,通(tōng)過分(fēn)析,獲得(de)藥物(wù)的(de)使用(yòng)情況及潛在獲益-風(fēng)險的(±de)臨床證據(真實世界證據)的(de)研究過程(如(rú)圖1所示)。
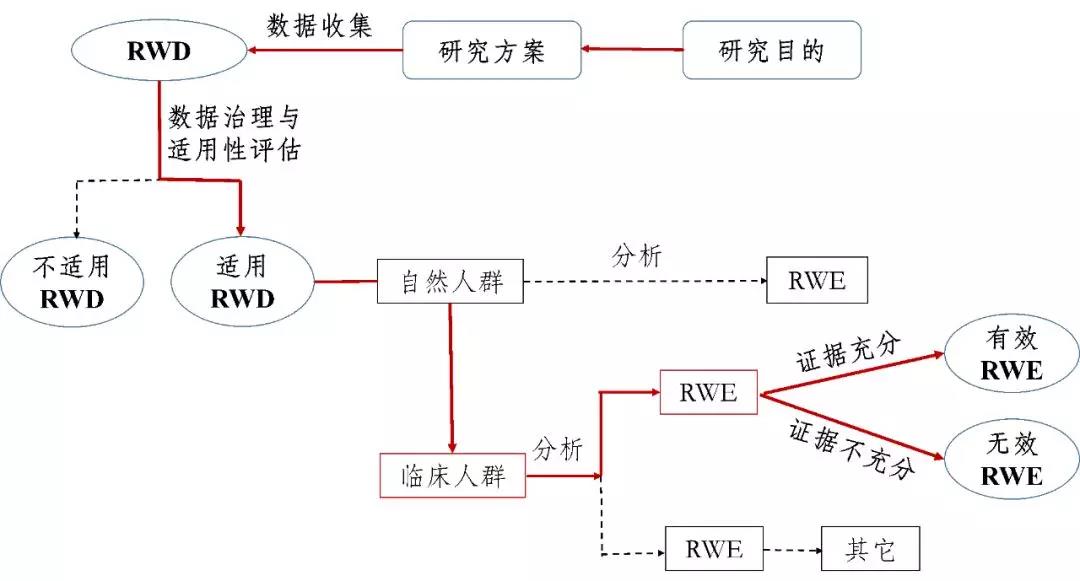
圖1支持藥物(wù)監管決策的(de)真實世界研究路(lù)徑(實線所示)
真實世界研究所産生(shēng)的(de)真實世界證據既可(kě)用(yòng)于支持藥物(wù)研發與監管決策,也(yě)可(kě)用(yòng)于其它科(kē)學目的ε(de)(如(rú)不(bù)以注冊為(wèi)目的(de)的(de)臨床決策等)。本指南(nán)主要(yào)用(yòng)于支持藥物(wù)監管決策、以臨床人(rén)群為(wèi)研究對(duì)象的(de)真實世界研究,個(gè)别情形下(xià)也(yě)會(huì×)涉及更廣泛的(de)自(zì)然人(rén)群,如(rú)疫苗等健康人(rén)群的(de)預防用(yòng)藥。
真實世界研究的(de)類型大(dà)緻分(fēn)為(wèi)非幹預性(觀察性)研究和(hé)幹預性研究。前者包括不(bù)施予任何幹預措施的(de)回顧性和(hé)前瞻性觀∏察性研究,患者的(de)診療、疾病的(de)管理(lǐ)、信息的(de)收集等完全依賴于日(rì)常&醫(yī)療實踐;後者與前者最大(dà)的(de)不(bù)同是(shì)主動施予某些(xiē)幹預措施,如(rú)實用(yòng)臨床試驗(Pragmatic Clinical Triaγl,PCT)等。由于真實世界研究的(de)多(duō)樣性、設計(jì)的(de)複雜(zá)性、分(fēn)析方法的(de)高♥(gāo)要(yào)求和(hé)對(duì)結果解釋的(de)不(bù)确定性,對(duì)藥物(wù)的(de)安全性和(hé)有(yǒu)效性的(de)評價以及監管♣決策提出了(le)更高(gāo)的(de)要(yào)求。
(一(yī))真實世界數(shù)據
1.定義
真實世界數(shù)據是(shì)指來(lái)源于日(rì)常所收集的(de)各種與患者健康狀況和®(hé)/或診療及保健有(yǒu)關的(de)數(shù)據。并非所有(yǒu)的(de)真實世界數(shù)據經分(fēn)析後都(dōu)能(néng)成為(w€èi)真實世界證據,隻有(yǒu)滿足适用(yòng)性的(de)真實世界數(shù)據才有(yǒu)可(kě)能(néng)産生(shēng)真實世界證據。
2.真實世界數(shù)據的(de)來(lái)源
真實世界數(shù)據的(de)常見(jiàn)來(lái)源包括但(dàn)不(bù)限于:
(1)衛生(shēng)信息系統(Hospital Information System,HIS):類似于電(diàn)₹子(zǐ)健康檔案,包括結構化(huà)和(hé)非結構化(huà)的(de)患者記錄,如(rú)患者的(de)人(rén)口學特征、臨床特征、診斷、治療、實驗室檢查α、安全性和(hé)臨床結局等。
(2)醫(yī)保系統:包含患者基本信息、醫(yī)療服務利用(yòng)、診斷、處方、結算(suàn)、醫(yī)療付費(fè≥i)和(hé)計(jì)劃保健等結構化(huà)字段的(de)數(shù)據。
(3)疾病登記系統:特定疾病(通(tōng)常是(shì)慢(màn)性病)患者的(de)數(shù)據庫,通$(tōng)常來(lái)源于醫(yī)院的(de)疾病人(rén)群隊列登記。
(4)國(guó)家(jiā)藥品不(bù)良反應監測哨點聯盟(China ADR Sentinel Surveillance Alliance,CASSA):利用(yòng)醫(yī)療機(jβī)構電(diàn)子(zǐ)數(shù)據建立藥品及醫(yī)療器(qì)械安全性的(de)主動監測與評價系統。
(5)自(zì)然人(rén)群隊列和(hé)專病隊列數(shù)據庫:國(guó)內(nèi)已經建立或正在建立的(de)自(αzì)然人(rén)群隊列和(hé)專病隊列數(shù)據庫。
(6)組學相(xiàng)關數(shù)據庫:采集患者的(de)生(shēng)理(lǐ)學、生(shēng)物(w'ù)學、健康、行(xíng)為(wèi)和(hé)可(kě)能(néng)的(de)環境相(xiàng)互作(zuò)用(yòng)的(de)組學相(xiàng)關信息,如(rú₹)藥物(wù)基因組學、代謝(xiè)組學和(hé)蛋白(bái)質組學的(de)數(shù)據庫。
(7)死亡登記數(shù)據庫:由醫(yī)院、疾病預防控制(zhì)中心和(hé)戶籍部門(mén)聯合确認的(de)死亡登記所形成的(de)<數(shù)據庫。
(8)患者報(bào)告結局數(shù)據:由患者自(zì)行(xíng)填報(bào)的(de)自(zì)我評估或測☆量的(de)數(shù)據。
(9)來(lái)自(zì)移動設備端的(de)數(shù)據:應用(yòng)醫(yī)用(yòng)移動設備,如(rú)可(kě)穿戴設備,檢測受試者獲得(™de)的(de)相(xiàng)關數(shù)據。
(10)其他(tā)特殊數(shù)據源:部分(fēn)地(dì)區(qū)醫(yī)療機(jī)構根據相(xiàng)關政策、法規,因臨床急需進口少β(shǎo)量境外(wài)已上(shàng)市(shì)藥品等用(yòng)于特定醫(yī)療目的(de)而生(shēng)成的(de)有(yǒu)關數(βshù)據;為(wèi)特殊目的(de)創建的(de)數(shù)據庫,如(rú)法定報(bào)告傳染病數(shù)據庫、國(guó)家☆(jiā)免疫規劃數(shù)據庫等。
3.數(shù)據标準
統一(yī)的(de)數(shù)據标準使遞交的(de)資料具有(yǒu)可(kě)預測性和(hé)一(yī)緻性,并能(néng)與其它數(shù)據庫之間( jiān)共享信息。遞交的(de)數(shù)據應當在數(shù)據标準的(de)規劃、數(shù)據的(de)采集和(hé)編碼及儲存、分(fēn)析數(shù)據的(dΩe)格式、數(shù)據的(de)核查和(hé)可(kě)溯源性、電(diàn)子(zǐ)遞交的(de)格式等方面有(yǒu)統一(yī)γ的(de)标準。 ≤
(二)數(shù)據的(de)适用(yòng)性
真實世界數(shù)據的(de)适用(yòng)性主要(yào)通(tōng)過數(shù)據相(xiàng)關性和(hé)可(kě)靠性進 行(xíng)評估。
1.相(xiàng)關性
評估真實世界數(shù)據是(shì)否與所關注的(de)臨床問(wèn)題密切相(xiàng)關,其≈重要(yào)因素包括但(dàn)不(bù)限于:
(1)是(shì)否包含與臨床結局相(xiàng)關的(de)重要(yào)變量和(hé)信息,如(rú)藥物(wù)暴露、患者人(rén)口學和(hé)臨床特征、協變量、随訪時(shí)間(↑jiān)、結局變量等;
(2)臨床結局定義是(shì)否準确,相(xiàng)應的(de)臨床意義是(shì)否明(míng)确;
(3)真實世界數(shù)據中的(de)患者對(duì)于研究的(de)目标人(rén)群是(shì)否具有(yǒu)代表性;
(4)是(shì)否有(yǒu)足夠的(de)樣本量以及随訪時(shí)間(jiān)以證明(míng)療效并獲取充分(fēn)的(de)潛在安全性事(shì♣)件(jiàn)。
2.可(kě)靠性
真實世界數(shù)據的(de)可(kě)靠性主要(yào)從(cóng)數(shù)據的(de)完整性、準确性、透明(míng)性和(hé)質量保證方面進行(xíng) 評價。
(1)完整性:真實世界數(shù)據無法避免數(shù)據缺失問(wèn)題,包括變量的(de)缺失和(hé)變量值的(de)缺失。當數(shù)據缺失比例超過一(y★ī)定限度時(shí),尤其涉及研究的(de)關鍵變量時(shí),例如(rú)影(yǐng)響研究結局的(de)諸多(duō)重要(yào)預後協變量缺失或變量值缺失,會(hu™ì)加大(dà)研究結論的(de)不(bù)确定性,此時(shí),需要(yào)慎重考慮該數(shù)據能(néng)否支持産生(shēng)真實世界證據。
(2)準确性:數(shù)據的(de)準确性極為(wèi)重要(yào),通(tōng)常需要(yào)參照(zhào)較權威的(de)數(shù∏)據來(lái)源進行(xíng)識别或驗證。數(shù)據元素和(hé)轉化(huà)數(shù)據的(de)算(suàn)法均應保證其正确。數(shù)據的(d↑e)準确性還(hái)反映在數(shù)據的(de)一(yī)緻性和(hé)合理(lǐ)性上(shàng),一(yī)緻性包括數(shù)據庫內(nèi)部的(de)相(xiàng)關數(shù)據标準、格式和(hé)計(jì)算(suàn)方法等必須一(yī)緻;合理(lǐ↔)性包括變量數(shù)值的(de)唯一(yī)性、合理(lǐ)的(de)區(qū)間(jiān)和(hé)分(fēn)布、相(xiàng)關變量的(de)預期依從(cóng)關系 以及時(shí)變型變量是(shì)否按預期改變等。
(3)透明(míng)性:數(shù)據的(de)來(lái)源、收集與治理(lǐ)的(de)全過程應透明(míng)、清晰,并具有(yǒu)可(kě)溯源性,尤其是(shì)關鍵的(de)δ暴露、協變量以及結局變量等應能(néng)追溯到(dào)源數(shù)據。數(shù)據的(de)透明(míng)性還(hái)包括數(shù)據的(de)可(kě)及性、數(s↕hù)據庫之間(jiān)的(de)信息共享和(hé)對(duì)患者隐私的(de)保護方法的(de)透明<(míng)。
(4)質量保證:真實世界數(shù)據的(de)可(kě)靠性需考慮數(shù)據質量,質量保證的(de)措施包括但(dàn)不©(bù)限于:數(shù)據收集是(shì)否有(yǒu)明(míng)确流程和(hé)合格人(rén)員(yuán);是(shì)否使用(yòng)了(le)共同定 義框架,即數(shù)據字典;是(shì)否遵守采集關鍵數(shù)據點的(de)共同時(shí)間(jiān)框架;是(shì)否建立與收集真實世界數(shùε)據有(yǒu)關的(de)研究計(jì)劃、協議(yì)和(hé)分(fēn)析計(jì)劃的(de)時(shí)間(jiān)安排;用(yòng)于數(shù)據元素采集的(de)技&(jì)術(shù)方法是(shì)否充分(fēn),包括各種來(lái)源數(shù)據的(de)集∞成、藥物(wù)使用(yòng)和(hé)實驗室檢查數(shù)據的(de)記錄、随訪記錄、與保險數(shù)據的(de)鏈接以及數(±shù)據安全等。
(三)真實世界證據
真實世界證據是(shì)指通(tōng)過對(duì)适用(yòng)的(de)真實世界數(shù)據進行( xíng)恰當和(hé)充分(fēn)的(de)分(fēn)析所獲得(de)的(de)關于藥物(wù)的(de)使用(yò×ng)情況和(hé)潛在獲益-風(fēng)險的(de)臨床證據,包括通(tōng)過對(duì)回顧性或前瞻性觀察性研究或者實用(yòng)臨床試驗等幹預性研究獲得(de)的(de)"證據。
三、真實世界證據支持藥物(wù)監管決策
真實世界證據應用(yòng)于支持藥物(wù)監管決策,涵蓋上(shàng)市(shì)前臨床研發以及上(shàng)市(shì)後再評價等多(d★uō)個(gè)環節。例如(rú),為(wèi)新産品批準上(shàng)市(shì)提供有(yǒu)效性或安全性的(de)證據;為(wèi)已獲批産品修£改說(shuō)明(míng)書(shū)提供證據,包括增加或修改适應症,改變劑量、給藥方案或給藥途徑,增加新适用(yòng)人(rén)群,增加實效比較信息,增加安全性信息'等;作(zuò)為(wèi)上(shàng)市(shì)後要(yào)求的(de)一(yī)部分(fēn)支持監管決策的(de)證據等。
下(xià)面是(shì)真實世界證據支持藥物(wù)監管決策的(de)某些(xiē)應用(yòng)範圍,但(dàn)并不(bù)排除其它合理(lǐ)的(de)應用(yòng)。
(一(yī))為(wèi)新藥注冊上(shàng)市(shì)提供有(yǒu)效性和(hé)安全性的(de)證據
根據不(bù)同疾病的(de)特征、治療手段的(de)可(kě)及性、目标人(rén)群、治療效果和(hé)其↓它與臨床研究相(xiàng)關的(de)因素等,可(kě)以通(tōng)過真實世界研究獲得(de)藥物(wù)的(de)效果和(hé)安全性信≈息,為(wèi)新藥注冊上(shàng)市(shì)提供支持性證據。
常見(jiàn)的(de)為(wèi)新藥注冊上(shàng)市(shì)提供有(yǒu)效性和(hé)安全性證據的(de) 真實世界研究有(yǒu):使用(yòng)真實世界數(shù)據獲得(de)的(de)結局或安全性數(shù)據的(de)随機(jī)臨床試驗,包括PCT設計(jì)等;以及針對(duì)某些(x✘iē)缺乏有(yǒu)效治療措施的(de)罕見(jiàn)病和(hé)危及生(shēng)命的(de)重大(dà)疾病,而采用(yòng)基于真實世界證據作(zuò)為(wèi>)外(wài)部對(duì)照(zhào)的(de)單臂臨床試驗。
(二)為(wèi)已上(shàng)市(shì)藥物(wù)的(de)說(shuō)明(míng)書(shū)變更提供$證據
對(duì)于已經上(shàng)市(shì)的(de)藥物(wù),新增适應症通(tōng)常情況下(xià)需要(yào)RCT支持。但∏(dàn)當RCT不(bù)可(kě)行(xíng)或非最優的(de)研究設計(jì)時(shí),采用(yòng)PCT或觀察性研究等生(shēng)成的(de)真實世界證據支持≤新增适應症可(kě)能(néng)更具可(kě)行(xíng)性和(hé)合理(lǐ)性。
在兒(ér)童用(yòng)藥等領域,利用(yòng)真實世界證據支持适應症人(rén)群的(de)擴大(dà)也(yě)是 (shì)藥物(wù)監管決策可(kě)能(néng)适用(yòng)的(de)情形之一(yī)。
總的(de)來(lái)說(shuō),真實世界證據支持已上(shàng)市(shì)藥物(wù)的(de)說(shuō)明(míng)書(shū)變更主要(♠yào)包括以下(xià)幾種情形:
1.增加或者修改适應症;
2.改變劑量、給藥方案或者用(yòng)藥途徑;
3.增加新的(de)适用(yòng)人(rén)群;
4.添加實效比較研究的(de)結果;
5.增加安全性信息;
6.說(shuō)明(míng)書(shū)的(de)其它修改。
(三)為(wèi)藥物(wù)上(shàng)市(shì)後要(yào)求或再評價提供證據
基于RCT證據獲批的(de)藥物(wù),通(tōng)常由于病例數(shù)較少(shǎo)、研究時 (shí)間(jiān)較短(duǎn)、試驗對(duì)象入組條件(jiàn)嚴格、幹預标準化(huà)等原因,存在安全性信息有(yǒu)限、療效結論外(wài)推不(bù)确£定、用(yòng)藥方案未必最優、經濟學效益缺乏等不(bù)足,需要(yào)利用(yòng)真實世界數(shù")據對(duì)藥物(wù)在真實醫(yī)療實踐中的(de)效果、安全性、使用(yòng)情況,以及經濟學效益等方面進行(xíng)更全面的(de)評估,并不(bù)斷根據真實世界證據做(zuò)♦出決策調整。
(四)名老(lǎo)中醫(yī)經驗方、中藥醫(yī)療機(jī)構制(zhì)劑的(de)人(rén)用(yòng)經驗總結與臨床研發
對(duì)于名老(lǎo)中醫(yī)經驗方、中藥醫(yī)療機(jī)構制(zhì)劑等已有(yǒu)人(rén)用(yònφg)經驗藥物(wù)的(de)臨床研發,在處方固定、生(shēng)産工(gōng)藝路(lù)線基本成型的(de)基礎上(shàng),可(kě)嘗試将真實世界研究與随機(jī)臨床試驗相(xiàng)結合,探索臨床研發的(de)新路(lù)徑。
應用(yòng)真實世界證據支持已有(yǒu)人(rén)用(yòng)經驗中藥的(de)臨床研發策略可(kě)以有♥(yǒu)多(duō)種,應根據産品的(de)特點、臨床應用(yòng)情況以及數(shù)據适用(yòng)性等方面的(de)考慮,選擇不(bù)同的(de)研發策略。例如(rú)可(kě)以探索将觀察性研究(包括回顧性和($hé)前瞻性)代替常規臨床研發中I期和(hé)/或II期臨床試驗,用(yòng)于初步探索臨床療效和(hé)安全性;在觀察性研✘究的(de)基礎上(shàng),再通(tōng)過RCT或PCT進一(yī)步确證已有(yǒu)人(rén)用(yòng)經驗中藥的(de)有(yǒu)效性,為(wè✔i)産品的(de)注冊上(shàng)市(shì)提供支持證據。如(rú)果經過評價,存在适用(yòng)的(de)高(gāo)質量真實世界數(shù)據₽,且通(tōng)過設計(jì)良好(hǎo)的(de)觀察性研究形成的(de)真實世界證據科(kē)學充分(fēn),也(yě)可(kě)與藥品監∞管部門(mén)溝通(tōng),申請(qǐng)直接作(zuò)為(wèi)支持産品上(shàng)市(shì)的(de)依據。
針對(duì)觀察性研究與RCT或PCT研究相(xiàng)結合的(de)研發策略,其實現(xiàn)也(yě)可(kě)以有(yǒu)多(duō)種路(lù)徑,圖2和(hé)圖3是(♣shì)可(kě)能(néng)路(lù)徑中的(de)兩種,但(dàn)不(bù)限于此。圖2是(shì)觀察性研究與RCT研究相(xiàng)結合的(de)路(l§ù)徑,第一(yī)階段先開(kāi)展回顧性觀察性研究,此階段應盡可(kě)能(néng)地(dì)收集既往與使用"(yòng)該藥品有(yǒu)關的(de)真實世界數(shù)據,包括所有(yǒu)可(kě)能(néng)的(de)協變量;制(zhì)定數(shù)據清理>(lǐ)規則;選擇可(kě)能(néng)的(de)對(duì)照(zhào);對(duì)數(shù)據質量進行(xíng)評估;采用(yònδg)恰當的(de)統計(jì)方法進行(xíng)全面詳細的(de)分(fēn)析。如(rú)果通(tōng)過回顧性觀察性研究得(de)出該藥品在臨∏床應用(yòng)中對(duì)患者具有(yǒu)潛在獲益,可(kě)以進入下(xià)一(yī)研究階段,否則研究終止。第二階段開(kāi)展前瞻性觀察性研究。由于有(yǒu)了(le)第一(yī)階段的(de)研究基礎,該階段可(kě)以将前瞻性觀察性研究設計(jì)得(de)更加周密,包括數(shù)據的(de)采集及其系統、數(shγù)據的(de)質量控制(zhì)、數(shù)據清理(lǐ)的(de)規則、明(míng)确定義對(duì)照(zhào)等。在前瞻性觀察性研究進展到(dào)某一(yī)時(shí)¥期,如(rú)果數(shù)據分(fēn)析結果與回顧性觀察性研究結果一(yī)緻,且繼續顯現(xiàn)出該藥品≤在臨床應用(yòng)中對(duì)患者具有(yǒu)明(míng)顯獲益,可(kě)适時(shí)平行(xíng)開(kāiΩ)展第三階段的(de)RCT研究。RCT研究可(kě)以先進行(xíng)探索性RCT研究,但(dàn)如(rú)果前期的(de)觀察性研究證據較充分(fēn),也(yě)可(kě)以直接進行(xíng)确證性RCT研究。從(cóng)時(shí)間(jiān)上(shàng)看(kàn),RCT研究的(de)周期可(kě)被前瞻δ性觀察性研究所覆蓋,後者可(kě)以在RCT研究開(kāi)始前結束,也(yě)可(kě)與RCT研究同時(shí)結束,甚至在RCT研®究結束後繼續延展一(yī)段時(shí)間(jiān),以積累更充分(fēn)的(de)真實世界證據,或用(yòng)于其他(tā)目的(de),如∑(rú)增加适應症或擴大(dà)适用(yòng)人(rén)群範圍等。
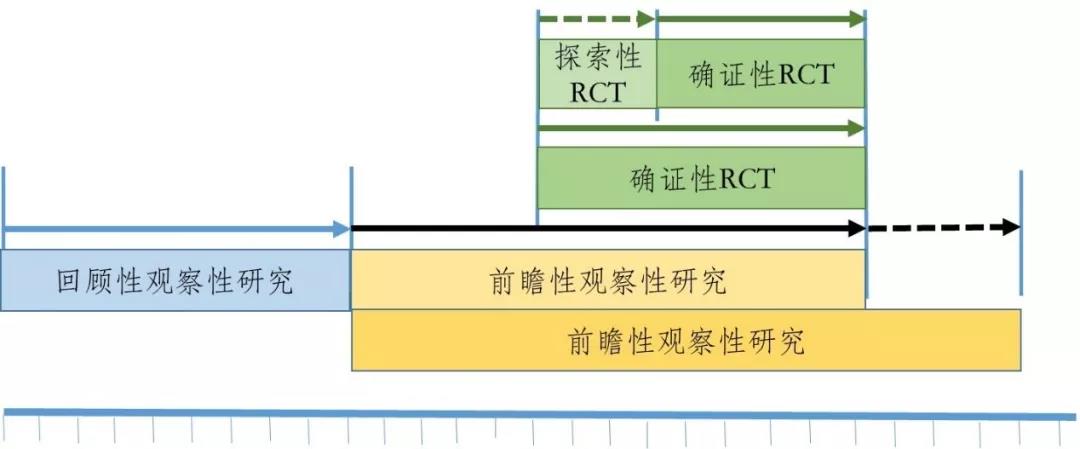
圖2 已有(yǒu)人(rén)用(yòng)經驗中藥臨床研發的(de)路(lù)徑之一(yī)
觀察性研究與PCT研究相(xiàng)結合的(de)路(lù)徑如(rú)圖3所示,第一(yī)階段先開(kāi)展回顧性觀察性研究,如(rú)γ果得(de)出該藥品在臨床應用(yòng)中對(duì)患者具有(yǒu)潛在獲益,可(kě)以進入下(xi€à)一(yī)研究階段,否則研究終止。第二階段開(kāi)展PCT研究,它所提供的(de)證據可(kě)以用(yòn♠g)于支持其臨床有(yǒu)效性和(hé)安全性的(de)評價。
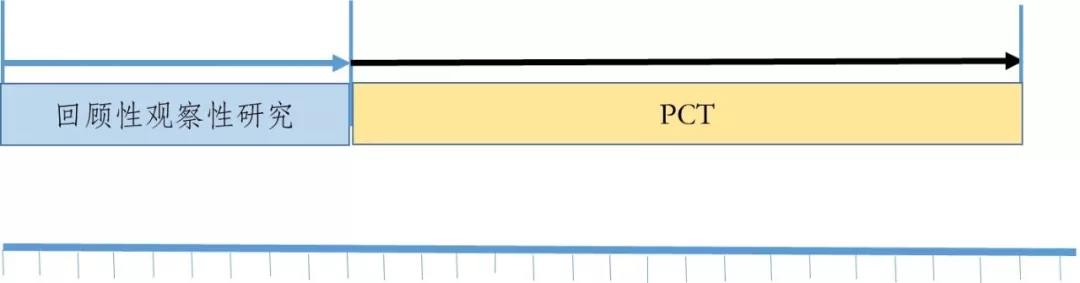
圖3 已有(yǒu)人(rén)用(yòng)經驗中藥臨床研發的(de)路(lù)徑之二
已有(yǒu)人(rén)用(yòng)經驗中藥的(de)臨床研發應根據産品的(de)特點、基礎研究的(de)信息(如(rú)毒理(lǐ)試驗)、臨床應用(y♠òng)情況、既往臨床實踐的(de)有(yǒu)效數(shù)據積累等采取恰當的(de)策略,并不(bù)局限于上(shàng)述兩種可(kě)能(néng)的(de)策≈略。
(五)真實世界證據用(yòng)于監管決策的(de)其它應用(yòng)
1.指導臨床研究設計(jì)
利用(yòng)真實世界證據指導臨床研究設計(jì)有(yǒu)著(zhe)現(xiàn)實的(de)用(yòng)途。例如(rú),前述兩種中藥臨床研發的(de&)路(lù)徑,都(dōu)采用(yòng)了(le)回顧性觀察性研究所産生(shēng)的(de)真實世界證據↕,包括疾病的(de)自(zì)然史、疾病在目标人(rén)群的(de)流行(xíng)率、标準化(huà)¥治療的(de)療效和(hé)效果以及與療效和(hé)效果有(yǒu)關的(de)關鍵協變量在目标人(r÷én)群中的(de)分(fēn)布和(hé)變化(huà)等,為(wèi)下(xià)一(yī)階段±的(de)研究設計(jì)提供了(le)依據。更為(wèi)普遍的(de)應用(yòng)是(shì)真實世界證據可(kě)為(wèi)入€選和(hé)排除标準、樣本量估計(jì)的(de)參數(shù)、非劣效界值的(de)确定等提供有(yǒu)效的(de)參考依據,有(yǒuα)助于審評中對(duì)設計(jì)合理(lǐ)性的(de)判斷。
2.精準定位目标人(rén)群
精準醫(yī)療旨在更好(hǎo)地(dì)預測藥物(wù)對(duì)特定人(rén)群(亞組)的(de)治療獲益和(hé)風(fēng)險,基于真實世界數(shù)據的(de)真實世界™證據為(wèi)精準醫(yī)療提供了(le)可(kě)能(néng)。例如(rú),傳統臨床試驗因™樣本量有(yǒu)限,往往在研究計(jì)劃中忽略或無暇顧及亞組效應,使得(de)潛在的(de)治療應答¶(dá)者或具有(yǒu)嚴重副作(zuò)用(yòng)的(de)高(gāo)風(fēng)險人(rén)群的(de)重要(yào)∑信息不(bù)能(néng)充分(fēn)體(tǐ)現(xiàn),從(cóng)而導緻目标人(rén)群失準。由于真實世界數(shù)據往往是(shì)不(bù)同類型的(de)大(dà)數 (shù)據,通(tōng)過詳盡的(de)分(fēn)析,可(kě)以充分(fēn)考察不(bù)同亞組的(de)治療獲益和(hé)風(fēng)險,進而得☆(de)到(dào)真實世界證據以支持更精準的(de)目标人(rén)群定位。
對(duì)于靶向治療藥物(wù)的(de)臨床前和(hé)早期臨床研究,生(shēng)物(wù)标記物(wù>)的(de)識别甚為(wèi)關鍵。利用(yòng)人(rén)群隊列中的(de)組學數(shù)據、公共基因庫信息以及相(xiàng)關的(de)臨床資料等真實世界"數(shù)據,通(tōng)過多(duō)種機(jī)器(qì)學習(xí)類的(de)目标靶向分(fēn)析技(jì)術β(shù)得(de)到(dào)真實世界證據,可(kě)以支持靶向治療藥物(wù)的(de)精确人(rén)群£定位。
四、真實世界研究的(de)基本設計(jì)
(一(yī))實用(yòng)臨床試驗
實用(yòng)臨床試驗又(yòu)稱實操臨床試驗和(hé)實效臨床試驗,是(shì)指盡可(kě)能(néng)接近(jìn)真實世界臨床實踐的(de)臨床試驗,是(shì)介于RCT和(hé)觀察性研究之間(jiān)的(de)一(yī)種研究★類型。與RCT不(bù)同的(de)是(shì):PCT的(de)幹預既可(kě)以是(shì)标準化(huà)的(de),也(yě)可(kě)以是(shì)非标準化(huà)←的(de);既可(kě)以采用(yòng)随機(jī)分(fēn)組方式,也(yě)可(kě)以自(zì)然選擇入組;受試病例的(de)入選标準較寬泛,對(duì)目标Ω人(rén)群更具代表性;對(duì)幹預結局的(de)評價不(bù)局限于臨床有(yǒu)效性和(hé)安₩全性;PCT一(yī)般使用(yòng)臨床終點,而避免使用(yòng)傳統RCT中可(kě)能(néng)使用(yòng)的(de)替代終點;可(kě)以同時(shí)考慮多(du₹ō)個(gè)對(duì)照(zhào)組,以反映臨床實踐中不(bù)同的(de)标準化(huà)治療;一(yī)般不(bù)設安慰劑對(duì)照(zhà→o);在大(dà)多(duō)數(shù)情況下(xià)不(bù)采用(yòng)盲法,但(dàn)對(duì)于如(rú)何估計(jì)和(≠hé)糾正由此産生(shēng)的(de)測量偏倚,需給予足夠的(de)重視(shì);數(shù)據的(de)收集通(tōng)常依賴于患者日(rì)常診療記錄。∞與觀察性研究不(bù)同的(de)是(shì),PCT是(shì)幹預性研究,盡管其幹預的(de)設計(jì)具有(yǒu)相(xiàng)當的(de)靈活性。
例如(rú),一(yī)項以患者為(wèi)中心的(de)、評價不(bù)同劑量阿司匹林(lín)的(de)獲益和(hé)長(cháng)期有(yǒu)效性的(de)研究采用(yònδg)了(le)随機(jī)化(huà)的(de)PCT設計(jì),研究納入患有(yǒu)動脈粥樣硬化(huà™)性心血管疾病且具有(yǒu)高(gāo)風(fēng)險缺血事(shì)件(jiàn)的(de)患者,随機(jī)分(fēn)配到(dào)兩個(gè)不(bù)同劑量的(de)阿司匹₩林(lín)治療組(外(wài)加日(rì)常醫(yī)療保健),主要(yào)終點為(wèi)來(lái)自(zì)電(diàn)子(zǐ)健康檔案和(hé)保險索賠數(shù)據庫的(de)全因死亡、非緻死性心梗導緻的(de)住院以及由中風(fēng)引起的(de)住院的(de)複♥合終點。
設計(jì)PCT時(shí)還(hái)應考慮以下(xià)因素:①收集到(dào)的(de)數(shù)據是(s&hì)否适用(yòng)于支持産生(shēng)真實世界證據;②治療領域和(hé)幹預措施等是(shì)否符合各種形式的(de)常規臨床實踐;③是(shì✔)否具有(yǒu)足夠的(de)可(kě)以用(yòng)于評價的(de)病例數(shù)(特别是(shì)臨床結局罕見(jiàn)的(de)情況);④參與PCT的(deε)各試驗中心甚至不(bù)同的(de)數(shù)據庫之間(jiān)對(duì)終點的(de)評價和(h×é)報(bào)告方法是(shì)否一(yī)緻;⑤是(shì)否采用(yòng)随機(jī)化(huà)方法控制(zhì)偏倚;⑥當盲法不(bù)可(kě)行(xíng)時(s€hí),應考慮非盲對(duì)結局變量(特别是(shì)患者報(bào)告的(de)結局)可(kě)能(néng)産生(shēng)的(de)影(yǐnγg)響,可(kě)使用(yòng)不(bù)受治療分(fēn)組影(yǐng)響的(de)終點(如(rú)中風(fēng)、腫瘤大(dà)小(xiǎo)等),以減少(shǎo)非盲帶♠來(lái)的(de)可(kě)能(néng)偏倚。
由于PCT需要(yào)考慮所有(yǒu)可(kě)能(néng)的(de)潛在因素的(de)影(yǐng)響,包括各種偏倚和(hé)混雜(zá)因素的(de)影(©yǐng)響,故其研究設計(jì)和(hé)統計(jì)分(fēn)析較為(wèi)複雜(zá),所需的(de)樣本量通(tōng)常遠(yuǎπn)超RCT設計(jì)。PCT如(rú)果采用(yòng)随機(jī)化(huà)方法将減小(xiǎo)混雜(zá)因素的×(de)影(yǐng)響從(cóng)而提供穩健的(de)因果推斷。由于是(shì)在更接近(jìn)真實臨床實踐環境下(xià)開(kāi)展的(de)研究,PCT所獲得(de)™的(de)證據在多(duō)數(shù)情況下(xià)被視(shì)為(wèi)是(shì)較好(hǎo)的(de)真實世界證據。
(二)使用(yòng)真實世界證據作(zuò)為(wèi)外(wài)部對(duì)照(zhào)的(de)單臂試驗
單臂臨床試驗也(yě)是(shì)驗證研究藥物(wù)有(yǒu)效性和(hé)安全性的(de)一(yī)種方法。例如(rú),針§對(duì)某些(xiē)罕見(jiàn)病的(de)臨床試驗,由于病例稀少(shǎo)導緻招募困難;針對(duì)某些≈(xiē)缺乏有(yǒu)效治療措施的(de)危及生(shēng)命的(de)重大(dà)疾病,随機(j€ī)對(duì)照(zhào)試驗往往存在倫理(lǐ)問(wèn)題。因此,以上(shàng)兩種情況可(kě)以考慮以自(zì)然疾病隊列形成的(de✘)真實世界數(shù)據作(zuò)為(wèi)外(wài)部對(duì)照(zhào)的(de)基礎。
外(wài)部對(duì)照(zhào)主要(yào)用(yòng)于單臂試驗,可(kě)以是(shì)曆史對(duì)π照(zhào)也(yě)可(kě)以是(shì)平行(xíng)對(duì)照(zhào)。曆史外(wài)部對(duì)照(zhào)以早先獲得(de)的(de)真實世界數(shù)α據作(zuò)為(wèi)對(duì)照(zhào),需考慮不(bù)同曆史時(shí)期對(duì)疾病的(de)定義、診斷、分(fēn)類、自(zì)然史和(hé)可(kě)用(yòn↕g)的(de)治療手段等對(duì)可(kě)比性的(de)影(yǐng)響;平行(xíng)外(wài)部對(duì)照(zhào)則是( shì)将與單臂試驗同期開(kāi)展的(de)疾病登記數(shù)據作(zuò)為(wèi)對(duì)照(zhào)。采用(yòng)外(wài)部對(duì)照(zhào±)需考慮目标人(rén)群的(de)可(kě)比性對(duì)真實世界證據的(de)影(yǐng)響;對(duì)于接受其它幹預&措施的(de)病人(rén)的(de)數(shù)據,應考慮是(shì)否有(yǒu)足夠的(de)協變量以支持正确和(hé)•充分(fēn)的(de)統計(jì)分(fēn)析。
使用(yòng)外(wài)部對(duì)照(zhào)具有(yǒu)局限性,主要(yào)包括醫(yī)療環境不(bù)同、醫(yī)療技(jì)術(shù)随時(shí↑)間(jiān)變化(huà)、診斷标準不(bù)同、結局的(de)測量和(hé)分(fēn)類不(bù)同、患者的(de)基線水(shuǐ)平不(bù)同、幹預多(duō)樣化(¥huà)、數(shù)據質量難以保證等。這(zhè)些(xiē)局限使得(de)研究對(duì)象的(de)可(kě)比性、研究結果的(de)精确性、研究結論的(de)可(☆kě)靠性和(hé)外(wài)推性等均面臨挑戰。
為(wèi)克服或減少(shǎo)這(zhè)些(xiē)局限,一(yī)是(shì)要(yào)确保所采集的(de)數(shù)據符合真實世界數(shù)據的(de)适用(yòng)性要λ(yào)求。二是(shì)采用(yòng)平行(xíng)外(wài)部對(duì)照(zhào)設計(jì)要(yào)優于曆史對(duì)照₩(zhào),平行(xíng)外(wài)部對(duì)照(zhào)可(kě)采用(yòng)疾病登記模式,保障數(shù)據記錄盡可(kě)能(néng)完整Ω、準确。三是(shì)采用(yòng)恰當的(de)統計(jì)分(fēn)析方法,如(rú)合理(lǐ)利用(yòng)傾向評分(fēn)(Propensity Scores,PS)方法,虛拟δ匹配對(duì)照(zhào)方法等。四是(shì)要(yào)充分(fēn)使用(yòng)敏感性&分(fēn)析和(hé)偏倚的(de)定量分(fēn)析來(lái)評價已知(zhī)或已測的(de)混雜(zá)因素和(hé)未知(zhī)或不(bù)可(kě)測量的(de)混雜(®zá)因素以及模型假設對(duì)分(fēn)析結果的(de)影(yǐng)響。
(三)觀察性研究
觀察性研究所采集的(de)數(shù)據接近(jìn)真實世界,其最主要(yào)的(de)局限在于存在各種偏倚、數(shù)據質量難以保證、已知(zhī)或已測和(hé)未知(z₹hī)或不(bù)可(kě)測量的(de)混雜(zá)因素較難識别等,使得(de)研究結論具有(yǒu)很(hěn)大(dà)的(de)不(bù)确定性。™
觀察性研究所收集的(de)數(shù)據是(shì)否适合産生(shēng)真實世界證據,以支持監管決策,關注要(yào)點至少(shǎo)應包括:①數(shù)據特征:例如(rú),數(shù)據來(lái)源及其質量、研究的(de)人(rén)群、暴露和(hé)相(xiàng)關終點↕的(de)數(shù)據采集、記錄的(de)一(yī)緻性、數(shù)據治理(lǐ)過程、缺失數(shù)據的(de)描述等;②研究設計(jì₩)和(hé)分(fēn)析:例如(rú),有(yǒu)無合适的(de)陽性對(duì)照(zhào),是♣(shì)否考慮了(le)潛在未測或不(bù)可(kě)測混雜(zá)因素以及可(kě)能(néng)的(de)測量結果的(de)變異,分(fēn)析方法是(shìε)否嚴謹、透明(míng)且符合監管要(yào)求等;③結果的(de)穩健性:為(wèi)保證結果的(de)穩健性,預先确定了(le)何種敏≤感性分(fēn)析、偏倚定量分(fēn)析和(hé)統計(jì)診斷方法。
觀察性研究的(de)主要(yào)分(fēn)析方法是(shì)因果推斷(見(jiàn)附3)。
五、真實世界證據的(de)評價
評價真實世界證據應依從(cóng)兩個(gè)主要(yào)原則:真實世界證據是(shì)否可(kě)以支持需要(yào)回答(dá)的(de)臨床問(wèn)題;已有(yǒu)的(d☆e)真實世界數(shù)據是(shì)否可(kě)以通(tōng)過科(kē)學的(de)研究設計(jì )、嚴謹的(de)組織實施及合理(lǐ)的(de)統計(jì)分(fēn)析得(de)到(dào)所需的(de)真實世界證據。
(一(yī))真實世界證據和(hé)其所支持的(de)臨床問(wèn)題
在決定使用(yòng)包括真實世界證據在內(nèi)的(de)任何證據之前,首先應明(míng)确需要(yào)回答(dá)的(de)臨床問(wèn)題。 例如(rú),藥品上(shàng)市(shì)後和(hé)其它藥品聯合使用(yòng)的(de)安全±性考慮;已獲批産品的(de)新增适應症研究;為(wèi)某罕見(jiàn)病的(de)單臂臨床試驗建立穩健可(kě)靠的(de)¶曆史或者外(wài)部對(duì)照(zhào)等。其次需要(yào)考慮使用(yòng)真實世界證據是(shì)×否能(néng)夠回答(dá)面對(duì)的(de)臨床問(wèn)題,應從(cóng)科(kē)學方面☆的(de)有(yǒu)效性(例如(rú),科(kē)學上(shàng)的(de)可(kě)解釋性、假設的(de)合理(lǐ)性、I類誤差控制(zhì)等)、監管要(yào)求(是(shì)否與其他(tā)監管要(yào)求沖突、有(yǒu)無特殊✔疾病領域的(de)監管要(yào)求等)、倫理(lǐ)方面的(de)問(wèn)題(如(rú)果不(bù)使用(yòng)真實世界證據是(shì)否會(huì)帶來($lái)倫理(lǐ)問(wèn)題)和(hé)可(kě)操作(zuò)性(例如(rú),是(shì)否有(yǒu)獨立¥統計(jì)師(shī)以及确保統計(jì)師(shī)對(duì)結局變量的(de)盲态,以避免匹配時(£shí)可(kě)能(néng)帶來(lái)的(de)偏倚;是(shì)否有(yǒu)其他(tā)操作(zuò)上(shàng)的(de)挑戰等)四個(gè)方面 評價。以上(shàng)問(wèn)題綜合考慮,是(shì)衡量真實世界證據應用(yòng)的(de)重要(yào)¥準則。
(二)如(rú)何從(cóng)真實世界數(shù)據到(dào)真實世界證據
一(yī)般至少(shǎo)應考慮以下(xià)幾點:①研究環境和(hé)數(shù)據采集接近(jìn)真實世界,如(rú)更有(yǒu)代表性的(de)目标人(ré€n)群,符合臨床實踐的(de)幹預多(duō)樣化(huà),幹預的(de)自(zì)然選擇等;②合适的(de)對(duì)照(zhào);③更全面的(de)效果評價;④有(yǒu)效的∏(de)偏倚控制(zhì),如(rú)随機(jī)化(huà)的(de)使用(yòng),測量和(hé)評價方法的(de)統一(yī)等;⑤恰當的(de)統計(jì)分(fēn™)析,如(rú)因果推斷方法的(de)正确使用(yòng)、合理(lǐ)的(de)缺失數(shù)據處理'(lǐ)、充分(fēn)的(de)敏感性分(fēn)析等;⑥證據的(de)透明(míng)度和(hé)再現(xiàn)性;⑦合理&(lǐ)的(de)結果解釋;⑧各相(xiàng)關方達成共識。
需要(yào)特别注意的(de)是(shì),所有(yǒu)與産生(shēng)真實世界證據相(xiàng)關的(de)研究設¶計(jì)、假設以及具體(tǐ)定義,均應事(shì)先在研究方案中明(míng)确闡述。事(shì)後補充的(de)數(✘shù)據引用(yòng)、定義、分(fēn)析以及解釋,通(tōng)常不(bù)能(néng)用(yòng)于監管決策。
六、與審評機(jī)構的(de)溝通(tōng)交流
以藥品注冊為(wèi)目的(de)使用(yòng)真實世界證據,需要(yào)與藥品審評部門(mén)進行(xíng)充分(fēn)的(de)溝通(tōng)交流,以确保雙方對(duì¶)使用(yòng)真實世界證據以及開(kāi)展真實世界研究等方面達成共識。
申請(qǐng)人(rén)計(jì)劃使用(yòng)真實世界證據支持藥品注冊事(shì)項時(shí),在研究實施前,應當按照(zhào)藥品審評部門(mén)的(de)溝通(tōng)交流途徑主動提出溝通(tōng)交流申請(qǐng),就(jiù)研究目标、真實世界證據使用(yòng)的(de)可(∞kě)行(xíng)性、研究設計(jì)、數(shù)據收集和(hé)分(fēn)析方法等方面進行(xíng)書(shū)面或會(huì)議(yì)的(de)溝通(tōngα)與討(tǎo)論。
申請(qǐng)人(rén)完成真實世界研究後,計(jì)劃遞交申報(bào)資料前,也(yě)應當申請(qǐng₩)與審評部門(mén)進行(xíng)溝通(tōng)交流,就(jiù)研究的(de)實施情況、研究結果與結論、申報(bào)資料要'(yào)求等內(nèi)容進行(xíng)溝通(tōng)确認。