國(guó)家(jiā)藥監局藥審中心關于發布《中藥注冊受理(lǐ)審查指南(nán)(試行(xíng))》的(de)通(tōn$g)告(2025年(nián)第41号)

中藥注冊受理(lǐ)審查指南(nán)(試行(xíng))
目錄
一(yī)、适用(yòng)範圍
二、受理(lǐ)部門(mén)
三、資料基本要(yào)求
(一(yī))申請(qǐng)表的(de)整理(lǐ)
(二)申報(bào)資料的(de)整理(lǐ)
四、形式審查要(yào)點
(一(yī))申報(bào)事(shì)項審查要(yào)點
(二)溝通(tōng)交流審查要(yào)
(三)申請(qǐng)表審查要(yào)點
(四)申報(bào)資料審查要(yào)點
(五)其他(tā)提示
五、受理(lǐ)審查決定
(一(yī))受理(lǐ)
(二)補正
(三)不(bù)予受理(lǐ)
(四)受理(lǐ)流程圖
六、其他(tā)
七、附件(jiàn)
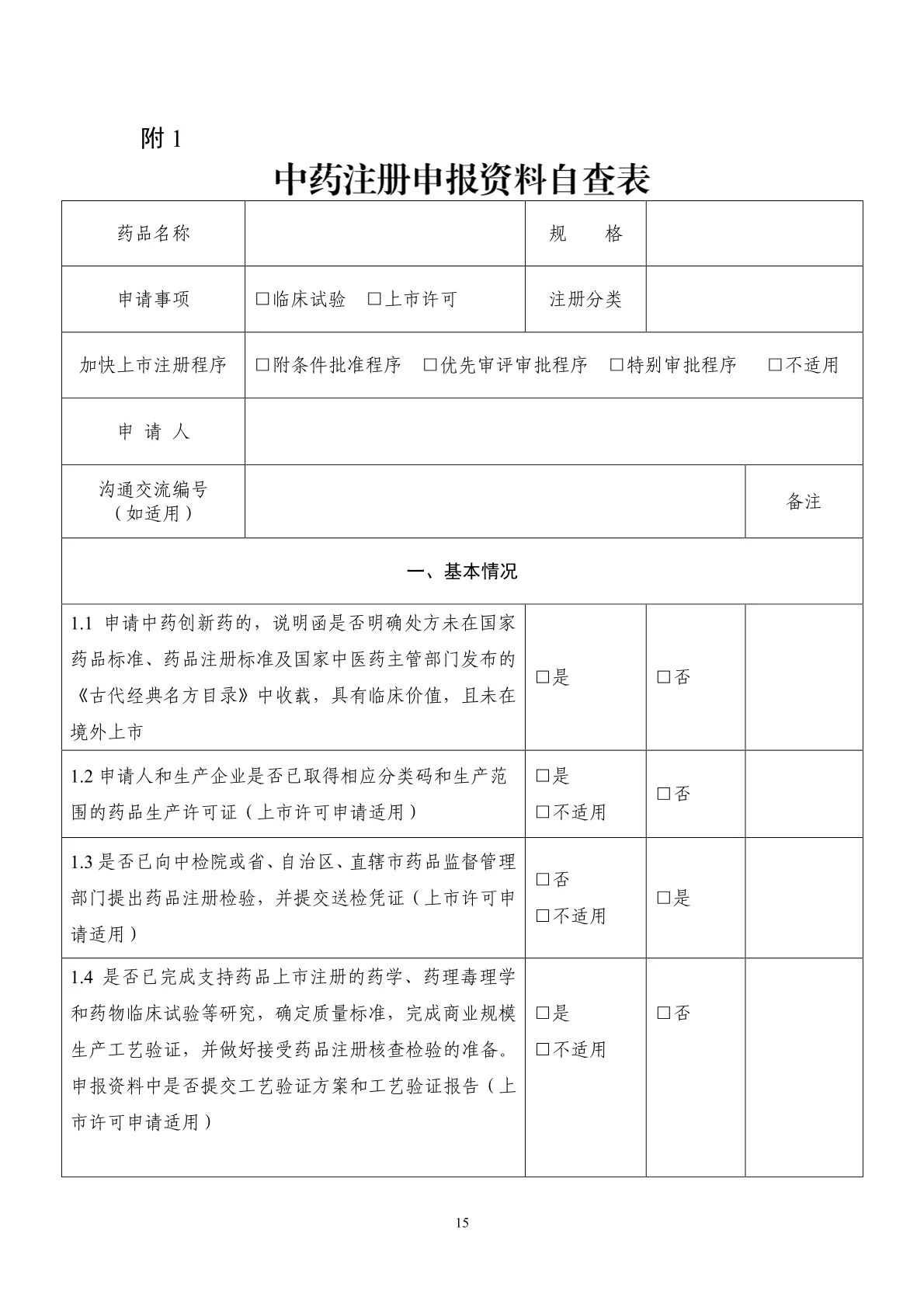
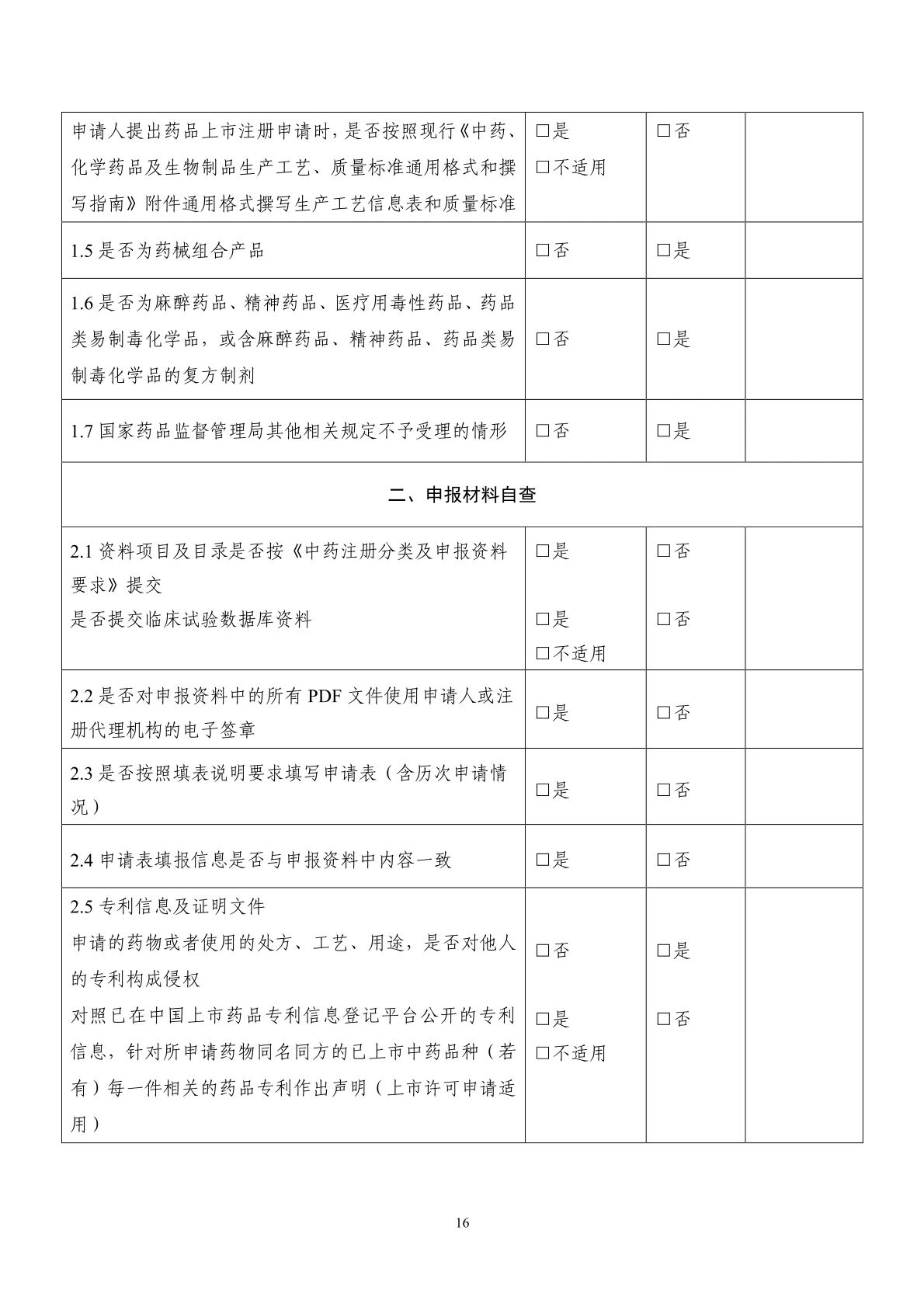
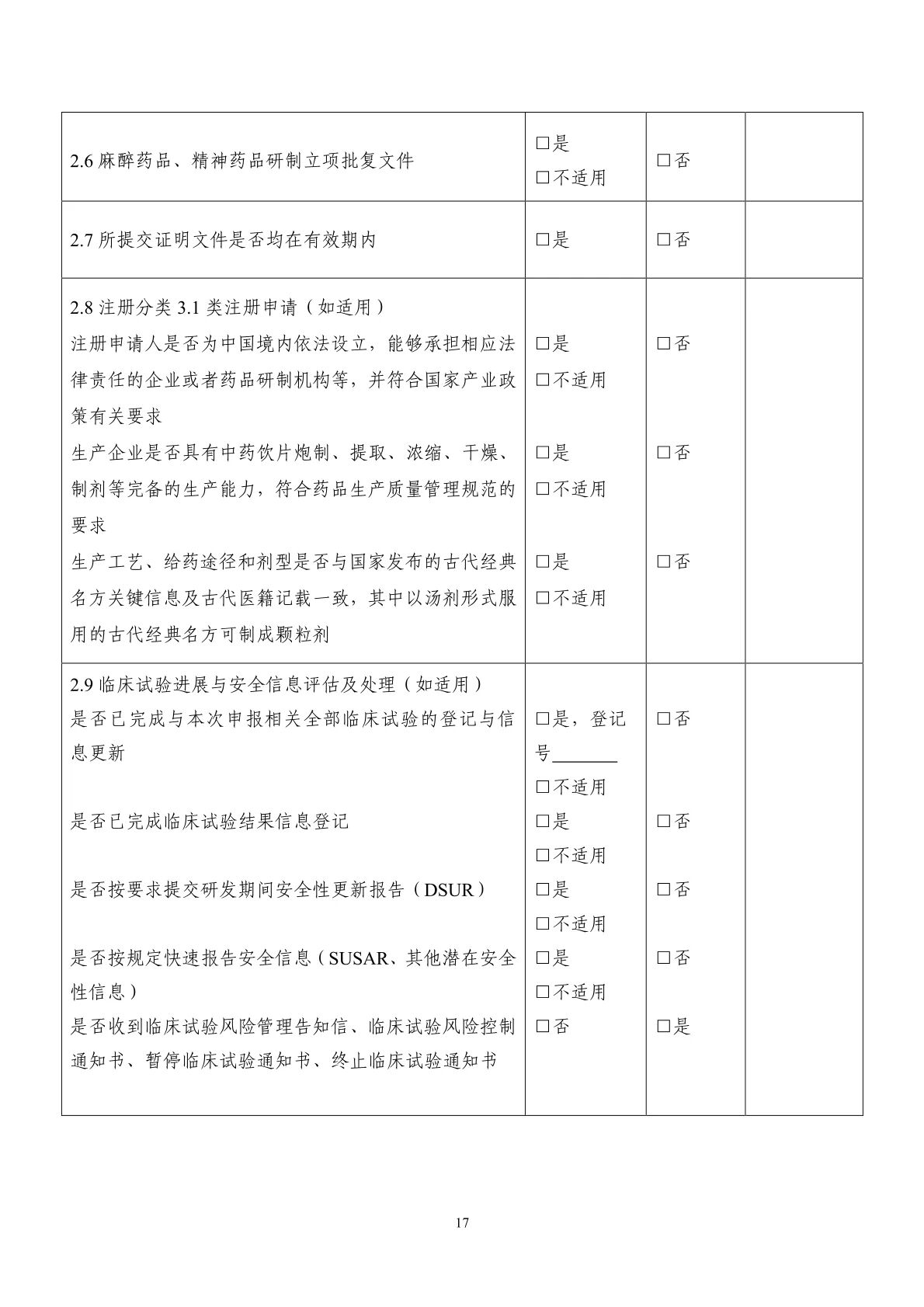
1中藥注冊申報(bào)資料自(zì)查表
2參考目錄
本指南(nán)基于現(xiàn)行(xíng)法律法規要(yào)求制(zhì)定,對(duì)于指南(nán)中未涵蓋或未≈明(míng)确的(de)受理(lǐ)事(shì)宜,申請(qǐng)人(rén)可(kě)與受理(lǐ)部門(mén)進行(xíng)溝通(tōngβ)。後續将根據相(xiàng)關法律法規等文(wén)件(jiàn)要(yào)求适時(shí)更新。
一(yī)、适用(yòng)範圍
中藥臨床試驗申請(qǐng)/藥品上(shàng)市(shì)許可(kě)申請(qǐng)。
二、受理(lǐ)部門(mén)
國(guó)家(jiā)藥品監督管理(lǐ)局藥品審評中心。
三、資料基本要(yào)求
按照(zhào)《藥品注冊管理(lǐ)辦法》《中藥注冊管理(lǐ)專門(mén)規定》及《中藥注冊分(fēn)類及申報(bào)資料要(yào)↕求》等規定,提供符合要(yào)求的(de)申報(bào)資料。申報(bào)資料的(de)格式、目錄及項目編号不(bù)能(néng)改變,對(duì)應項₹目無相(xiàng)關信息或研究資料,項目編号和(hé)名稱也(yě)應當保留,可(kě)在項下(xià)注明(míng)“無相(xiàng)關研究內(nèi)容”或“不(bù)适用(yòng)”。
申報(bào)資料的(de)撰寫還(hái)應參考相(xiàng)關法規、技(jì)術(shù)要(yào)求及技(jì)術(shù)指導原則的(de)相(xiàng)關規定。
申請(qǐng)表的(de)整理(lǐ)
藥品注冊申請(qǐng)表、申報(bào)資料自(zì)查表、小(xiǎo)型微(wēi)型企業(yè)收費(fèi)優惠申請(qǐng)表(如(rú)适用(yòng))填寫應當準确、完整、規範,☆不(bù)得(de)手寫或塗改,并應當符合填表說(shuō)明(míng)的(de)要(yào)求。
依據《國(guó)家(jiā)藥監局關于藥品注冊網上(shàng)申報(bào)的(de)公告》的(de)相(xiàng)關要(yào)求,申請(qǐng)人(rén)應當'通(tōng)過國(guó)家(jiā)藥品監督管理(lǐ)局政務服務門(mén)戶藥品業(yè)務應用(yòng)系統填報(bào)申請(qǐ↓ng)表,并完成在線提交。申請(qǐng)表各1 頁數(shù)據核對(duì)碼必須一(yī)緻。
申報(bào)資料的(de)整理(lǐ)
申請(qǐng)人(rén)應當按照(zhào)《國(guó)家(jiā)藥監局關于實施藥品注冊申請(qǐng)電(diàn)子(zǐ)申報(bào)的(★de)公告》《關于藥品注冊申請(qǐng)電(diàn)子(zǐ)申報(bào)有(yǒu)關要(yào)求的(de)通(tōng)知(zhī)》《國(guó)家(jiā)藥監局藥審中心關σ于更新〈申報(bào)資料電(diàn)子(zǐ)光(guāng)盤技(jì)術(shù)要(yào)求〉等文(wén)件(jiàn)的(de)通(tōng)知(zhī)》等要(yào)求,×準備全套電(diàn)子(zǐ)申報(bào)資料(按要(yào)求需提交臨床試驗數(shù)據庫的(de),♦應當同時(shí)包含臨床試驗數(shù)據庫資料),并對(duì)其中所有(yǒu) PDF 文(wén)件(jiàn)使用(yòng)申請(qǐng)人(rén)或注冊代理(lǐ)機(jī)構的(de)電(diàσn)子(zǐ)簽章(zhāng)。
申請(qǐng)人(rén)按照(zhào)《申報(bào)資料電(diàn)子(zǐ)光(guāng)盤技(jì)術(shù)要(y÷ào)求》準備的(de)藥品注冊電(diàn)子(zǐ)申報(bào)資料,可(kě)通(tōng)過網絡傳輸方式提交。
四、形式審查要(yào)點
申報(bào)事(shì)項審查要(yào)點
獲準開(kāi)展藥物(wù)臨床試驗的(de)藥物(wù)拟增加功能(néng)主治(或者适應症)以及增加與其他(tā)藥物(wù)聯合用(yòng)藥的(de),申請β(qǐng)人(rén)應當提出新的(de)藥物(wù)臨床試驗申請(qǐng),經批準後方可(kě)開(kāi)展新的(de)藥物(wù)臨床試驗。獲準上(₽shàng)市(shì)的(de)藥品增加功能(néng)主治(或者适應症)需要(yào)開(kāi)展藥物(wù)臨床試驗的(de),應當提出新的>(de)藥物(wù)臨床試驗申請(qǐng)。
2.藥物(wù)臨床試驗終止後,拟繼續開(kāi)展藥物(wù)臨床試驗的(de),應當重新提出藥物(wù)臨床試驗申請(qǐng)。藥物(wù)臨床試驗申請(qǐng)•自(zì)獲準之日(rì)起,三年(nián)內(nèi)未有(yǒu)受試者簽署知(zhī)情同意書(shū)的(de),該藥物(wù)臨床試驗許可(kě)自(zì)行(xín<g)失效;仍需實施藥物(wù)臨床試驗的(de),應當重新申請(qǐng)。
3.中藥創新藥和(hé)中藥改良型新藥藥物(wù)臨床試驗申請(qǐng)和(hé)藥品上(shàng)市(shì)許可(kě)申請(qǐng)按所申報(bào)的(de)适應症管理(lǐ)(不(bù∑)包括主治為(wèi)證候的(de)中藥複方制(zhì)劑)。同一(yī)藥物(wù)不(bù)同功能(néng)主治(或者适應症)應→當分(fēn)别提交注冊申請(qǐng)。對(duì)于同一(yī)功能(néng)主治(或者适應症)涉及多(®duō)個(gè)臨床試驗方案的(de)申請(qǐng),需在申請(qǐng)表其他(tā)特别申明(míng)事(shì)簡要(yào)♥說(shuō)明(míng)。
4.對(duì)于注冊分(fēn)類3類,申請(qǐng)人(rén)在完成相(xiàng)關研究後一(yī)次性直接提出古代經典名方中藥複方制(zhì)劑β的(de)上(shàng)市(shì)許可(kě)申請(qǐng)。
5.符合《藥品注冊管理(lǐ)辦法》第三十六條情形的(de),可(kě)以直接提出非處方藥上(shàng)市(shπì)許可(kě)申請(qǐng),同時(shí)應當在申請(qǐng)表中予以說(shuō)明(míng)。
6.藥品上(shàng)市(shì)許可(kě)申請(qǐng)審評期間(jiān),發生(shēng)可(kě)能(néng)影(yǐng)響藥品安♣全性、有(yǒu)效性和(hé)質量可(kě)控性的(de)重大(dà)變更的(de),申請(qǐng)人↕(rén)應當撤回原注冊申請(qǐng),補充研究後重新申報(bào)。申請(qǐng)人(rén)名稱變更、注冊地(dì)址名稱變更等不(bù)涉及技(jì)術(shù)審評內(nδèi)容的(de),應當及時(shí)書(shū)面告知(zhī)藥品審評中心并提交相(xiàng)關證明(míng)性資料。
(二)溝通(tōng)交流審查要(yào)點
1.申請(qǐng)附條件(jiàn)批準的(de),申請(qǐng)人(rén)應當就(jiù)附條件(jiàn)批準上(shàng)市(shì)的(de)條件(jiàn)和(hé)上(<shàng)市(shì)後繼續完成的(de)研究工(gōng)作(zuò)等與藥品審評中心溝通(tōng)交流,經溝通(tōng)交流确認後提出藥品上(shàng)市(shì)許可(kě•)申請(qǐng)。
2.申請(qǐng)優先審評審批的(de),申請(qǐng)人(rén)在提出藥品上(shàng)市(shì)許可(kě)申請(qǐng)前,應當與藥品審評中心溝通($tōng)交流,經溝通(tōng)交流确認後,在提出藥品上(shàng)市(shì)許可(kě)申請(qǐng)的(de)同時(shí),向藥品審評中心提出優先審評審批申請<(qǐng)。
3.溝通(tōng)交流應當符合《藥物(wù)研發與技(jì)術(shù)審評溝通(tōng)交流管理(lǐ)辦$法》等的(de)規定。
4.已申請(qǐng)溝通(tōng)交流的(de),應當提交與該申請(qǐng)相(xiàng)關的(de)溝通(tōng)交流編号、溝通(tōng)交流回複意見(jiàn),并就(jiù↔)回複意見(jiàn)進行(xíng)逐項答(dá)複。
(三)申請(qǐng)表審查要(yào)點
1.藥品注冊申請(qǐng)表
按照(zhào)藥品注冊申請(qǐng)表填表說(shuō)明(míng)的(de)要(yào)求規範填寫申請(qǐng)表,填報(bào)信息應當與證明₽(míng)性文(wén)件(jiàn)中相(xiàng)應內(nèi)容保持一(yī)緻。
藥品加快(kuài)上(shàng)市(shì)注冊程序:按照(zhào)該申請(qǐng)實際情況勾選。經溝通(tōng)交流确認後,勾選“附條件(jiàn)批準程序”;經溝通(tōng)交流确認後,勾選“優先審評審批程序”的(de),在提出藥品上(shàng)市(shì)許可(k★ě)申請(qǐng)的(de)同時(shí),按照(zhào)優先審評審批工(gōng)作(zuò)程序提出優先審評審批申請(qǐng);勾選“特别審批程序”的(de),應當按照(zhào)藥品特别審批程序辦理(lǐ)。
1.2 申請(qǐng)事(shì)項:按照(zhào)該申請(qǐng)實際申請(qǐng)事(shì)項填寫。申請(qǐng)臨床研究的(de),選擇“臨床試驗”;申請(qǐng)•上(shàng)市(shì)的(de),選擇“上(shàng)市(shì)許可(kě)”。
1.3 藥品注冊分(fēn)類:按照(zhào)《中藥注冊分(fēn)類及申報(bào)資料要(yào)求》等文(wén)✘件(jiàn)選擇。
1.4 其他(tā)事(shì)項:符合小(xiǎo)型微(wēi)型企業(yè)條件(jiàn)的(de)企業(yè)申請(qǐng)收費(fèi)優惠的(de),可™(kě)選小(xiǎo)微(wēi)企業(yè)收費(fèi)優惠。
1.5 藥品通(tōng)用(yòng)名稱:應當使用(yòng)國(guó)家(jiā)藥品标準或者藥品注冊标準收載的(de)藥品通(tōng)用(yòng)名稱。按照(zhào)相(xiàng)應β注冊類别需要(yào)自(zì)拟藥品名稱的(de),應當預先進行(xíng)藥品名稱查重工(gōng)作(zuò)。通(tōng)用(yòng)名稱未列入國(guó)家(j¥iā)藥品标準或者藥品注冊标準的(de),申請(qǐng)人(rén)在提出藥品上(shàng)市(shì)許可(kě)申請(qǐng)時(shí),應當提交通(t←ōng)用(yòng)名稱證明(míng)文(wén)件(jiàn),或同時(shí)提出通(tōng)用(yòng)名稱核準申請(qǐng)。注冊分(fēn)類3.1類無需申請(qǐng)藥品通(tōng)用(yòng)名稱核準,藥品通(tōng)用(yòng)名稱按照(zhào)《古代經典名方目錄》收載的(de)完整方劑名加劑型進行(xíng)表述。
1.6 英文(wén)名稱/拉丁名稱:中藥制(zhì)劑沒有(yǒu)英文(wén)名的(de),可(kě)以免填;申報(bào)中藥材需→提供拉丁名。
1.7 商品名稱:選擇“不(bù)使用(yòng)”。
1.8 同品種已被受理(lǐ)或同期申報(bào)的(de)其他(tā)制(zhì)劑及規格:填寫該品種已被受理(lǐ)或同期申報(bào)的(de)制(zhì)劑或不(♦bù)同規格品種的(de)受理(lǐ)号及名稱,包括聯合用(yòng)藥的(de)制(zhì)劑受理(lǐ)号及名稱。
1.9 原/輔料/包材來(lái)源:申報(bào)藥品注冊時(shí),應當填寫所用(yòng)的(de)相(xiàng)關信息,并應當與所提交的(de)證φ明(míng)文(wén)件(jiàn)/原料藥、藥用(yòng)輔料和(hé)藥包材登記信息公示平台中登記的(de)相(xiàng)應內(nèi)容保持一(yī)緻。
1.10 主要(yào)适應症或功能(néng)主治:應當與拟申請(qǐng)的(de)功能(néng)主治或适應症一(yī)緻。
1.11 是(shì)否涉及特殊管理(lǐ)藥品或成份:屬于麻醉藥品、精神藥品、醫(yī)療用(yòng)毒性藥品、放(fàng)射性藥品管理(lǐβ)的(de)特殊藥品,應當選填。
1.12 本次申請(qǐng)為(wèi):填寫申報(bào)品種相(xiàng)同申請(qǐng)事(shì)項 本次屬于第幾次申報(bào)。簡要(yào)說(shuō)明(míng)既往申報(bào)及審批情況,如(rú)申請(qǐng)人(rén)自(zì)行(xíng)撤回或因資料 不(bù)符合審批要(yào)求曾被國(guó)家(jiā)藥品監督管理(lǐ)局不(bù)予批準等情況。原申請(©qǐng)審批結束後,方可(kě)再行(xíng)申報(bào)。
1.13 曆次申請(qǐng)情況:若為(wèi)完成臨床研究申請(qǐng)上(shàng)市(shì)的(de),應當同時(shí)填寫臨床申請(→qǐng)受理(lǐ)号,以及臨床試驗登記号。
1.14 申請(qǐng)人(rén)及委托研究機(jī)構 所填報(bào)的(de)信息應當與證明(míng)性文(wén)件(jiàn)中相(xiàng)應內(nèi)容保持一(yī)緻,并指定其中一(yī)個 (gè)申請(qǐng)機(jī)構負責向國(guó)家(jiā)繳納注冊費(fèi)用(yòng)。已經填入的(de)申請(qǐng)人(rén)各機(jī)構均應當由其法定代表人(rén)←或接受其授權者(另需提供委托簽字授權書(shū),授權書(shū)應當加蓋公章(zhāng)(如(rú)有(yǒu)))在此簽名、加蓋機(jī)構電(diàn)子(zǐ)簽章(zhāng)。
2.小(xiǎo)型微(wēi)型企業(yè)收費(fèi)優惠申請(qǐng)表
如(rú)符合小(xiǎo)微(wēi)企業(yè)行(xíng)政事(shì)業(yè)性收費(fèi)優惠政策,可(kě)提交小(xiǎo)型微(wēi)型♣企業(yè)收費(fèi)優惠申請(qǐng)表并提供如(rú)下(xià)信息:
2.1 基本信息:如(rú)企業(yè)名稱、聯系人(rén)、聯系電(diàn)話(huà)等,應當與藥品注冊申請÷(qǐng)表有(yǒu)關信息一(yī)緻。
2.2 從(cóng)業(yè)人(rén)員(yuán)、上(shàng)一(yī)納稅年(nián)度營業(yè)收入、企業(yè)資産總值等:γ申請(qǐng)人(rén)依實際情況填寫。
2.3 應當由其法定代表人(rén)或接受其授權者(另需提供委托簽字授權書(shū),授權書(shū)應當加蓋公章(zhānαg)(如(rú)有(yǒu)))在此簽名、加蓋機(jī)構電(diàn)子(zǐ)簽章(zhāng)。
(四)申報(bào)資料審查要(yào)點 國(guó)家(jiā)藥品監督管理(lǐ)局發布的(de)關于取消證明(míng)事(shì)項的(de)公告中規定的(βde)“改為(wèi)內(nèi)部核查”的(de)證明(míng)事(shì)項,按公告要(yào)求執行(xíng)。
1.産品相(xiàng)關證明(míng)性文(wén)件(jiàn)
1.1 藥材/飲片、提取物(wù)等處方藥味,藥用(yòng)輔料及藥包材證明(míng)文(wén)件(jiàn)
1.1.1 藥材/飲片、提取物(wù)等處方藥味來(lái)源證明(míng)文(wén)件(jiàn)
1.1.2 藥用(yòng)輔料及藥包材合法來(lái)源證明(míng)文(wén)件(jiàn),包括供貨協議(yì)、 發票(piào)等(适用(yòng)于制(zhì)劑未選用(yòng)已登記輔包情形)。
1.1.3 藥用(yòng)輔料及藥包材授權使用(yòng)書(shū)(适用(yòng)于制(zhì)劑選用(yòng)已登記輔包情形)。如×(rú)為(wèi)供應商出具,需有(yǒu)藥用(yòng)輔料和(hé)藥包材企業(yè)授權,并附授權書(shū)。
1.2 專利信息及證明(míng)文(wén)件(jiàn) 申請(qǐng)的(de)藥物(wù)或者使用(yòng)的(de)處方、工(gōng)藝、用(yòng)途等專利情況及其¶權屬狀态說(shuō)明(míng),以及對(duì)他(tā)人(rén)的(de)專利不(bù)構成侵權的(de)聲明(míng),應當由申請(qǐng)人(rén)出具,并承諾對(duì)可(kě)能(néng)的(de)侵權後果承擔全部責任。同名同方藥申請¶(qǐng)人(rén)提交藥品上(shàng)市(shì)許可(kě)申請(qǐng)時(shí),應當按照(zhào)《藥品專利糾紛早期解決機(jī)制(zhì)實施辦法(試行(xín'g))》的(de)要(yào)求,對(duì)照(zhào)已在中國(guó)上(shàng)市(shì)藥品專利信息登記平台公開(kāi)的(de)專利信息,針對(duì)所申請(qǐng)∑藥物(wù)同名同方的(de)已上(shàng)市(shì)中藥品種(若有(yǒu))每一(yī)件(jiàn)相(xiàng)關的(de)藥品專利作(zuò)出聲明(m₽íng)。此外(wài),上(shàng)述專利聲明(míng)還(hái)需通(tōng)過國(guó)家(jiā)藥品監督管理(lǐ)局政務服務門(mén)戶藥品業'(yè)務應用(yòng)系統進行(xíng)填寫和(hé)提交。
1.3 麻醉藥品、精神藥品研制(zhì)立項批複文(wén)件(jiàn)(如(rú)适用(yòng))
1.4 對(duì)照(zhào)藥來(lái)源證明(míng)文(wén)件(jiàn)(如(rú)适用(yòng))
1.5 藥物(wù)臨床試驗相(xiàng)關證明(míng)文(wén)件(jiàn)(适用(yòng)于上(shàng)市(shì)許可(kě)申請(qǐ•ng)) 《藥物(wù)臨床試驗批件(jiàn)》/臨床試驗通(tōng)知(zhī)書(shū)、臨床試驗用(yòng)藥質量标準及臨床試驗登記号等相(xiàng)關材料,并就(jiù)《藥±物(wù)臨床試驗批件(jiàn)》/臨床試驗通(tōng)知(zhī)書(shū)中意見(jiàn)進行(xíng)逐項答(dá)複。
1.6 研究機(jī)構資質證明(míng)文(wén)件(jiàn)(如(rú)适用(yòng)) 非臨床研究安全性評價機(jī)構應當提供藥 品監督管理(lǐ)部門(mén)出具的(de)符合《藥物(wù)非臨床研究質量管理(lǐ)規範》(簡稱GLP)的(de)批準證明(míng)或檢查報(bào)告等證明(míng)性文(wén)件(jiàn)。臨床試驗 機(jī)構應當提供備案證明(míng)。
1.7 允許藥品上(shàng)市(shì)銷售證明(míng)文(wén)件(jiàn)(适用(yòng)于境外(wài)已上(shàng)市(shì)藥品)
1.7.1 境外(wài)藥品管理(lǐ)機(jī)構出具的(de)允許該藥品上(shàng)市(shì)銷售證明(míng)文(wén)件(jiàn)、公證認證文(↓wén)書(shū)及中文(wén)譯文(wén)。出口國(guó)或地(dì)區(qū)物(wù)種主管當局同意出口的(de)證明(míng)。
1.7.2 對(duì)于生(shēng)産國(guó)家(jiā)或地(dì)區(qū)按食品或按醫(yī)療器(qì)械管理(lǐ)的(de)制(zhì)劑,應當提供該國(guóα)家(jiā)或者地(dì)區(qū)有(yǒu)關管理(lǐ)機(jī)構允許該品種上(shàng)市(shì)銷售的(de)證明(míng)文(wén)件(jiàn)。
1.7.3 審評審批過程中,如(rú)相(xiàng)關證明(míng)性文(wén)件(jiàn)超過有(yǒu)效™期,申請(qǐng)人(rén)應當及時(shí)向藥品審評中心遞交更新的(de)證明(míng)性文(wénΩ)件(jiàn)。申請(qǐng)人(rén)應當同時(shí)承諾:審評審批期間(jiān),本文(wén)件(jiàn)載明(míng)的(de)境外(wài)監管狀态©信息,如(rú)生(shēng)産上(shàng)市(shì)情況、藥品生(shēng)産質量管理(lǐ)規範合規情況等內(nèi)容發生(shēng)變化(huà)的(de&),及時(shí)如(rú)實告知(zhī)監管部門(mén)。
1.7.4 境外(wài)藥品管理(lǐ)機(jī)構出具的(de)允許藥品變更的(de)證明(míng)文(wén)件(jiàn)、公證認證文(wén)書(shū)及中文(w&én)譯文(wén)(如(rú)适用(yòng))。
1.8 其他(tā)産品信息相(xiàng)關材料
1.8.1 藥械組合産品相(xiàng)關證明(míng)性文(wén)件(jiàn)(如(rú)适用(yòng)) 經屬性界定确認屬于藥品或以藥品為(wèi)主的(de)藥械組合産品,應當提交藥械組合産品的(de)屬性界定結果通(tōng)知(z≠hī)書(shū)。
1.8.2 改良型新藥和(hé)同名同方藥涉及相(xiàng)關中藥保護品種的(de),還(hái)需說(shuō)明(míng)相(xiàng)關對(dγuì)照(zhào)同名同方藥是(shì)否在中藥品種保護期內(nèi)。
2.申請(qǐng)人(rén)/生(shēng)産企業(yè)證明(míng)性文(wén)件(jiàn) 審評審批過程中,如(rú)相(xiàng)關證明(míng)性文(wén)件(jiàn)超過有(yǒu) 效期,申請(qǐng)人(rén)應當及時(shí)向藥品審評中心遞交更新的(de)證明(míng)性文(wén)件(jiàn)。
2.1 申請(qǐng)人(rén)資質證明(míng)文(wén)件(jiàn)
2.1.1 境內(nèi)申請(qǐng)人(rén)機(jī)構合法登記證明(míng)文(wén)件(jiàn)(營業(yè)執照(zhào)等)、相(xiàng)應的(de)《藥品生(shēng)産許可(÷kě)證》及變更記錄頁(适用(yòng)于上(shàng)市(shì)許可(kě)申請(qǐng))。 申請(qǐng)人(rén)自(zì)行(xíng)生(shεēng)産所申報(bào)藥品的(de):《藥品生(shēng)産許可(kě)證》分(fēn)類碼應當包含标識A,且具備相(xiàng)應生(shēng)産範圍;申請(qǐng)人(rén)委托其他(tā)生(shēng)産企業(yè)生(shēng)産所申報(bào>)藥品的(de):申請(qǐng)人(rén)《藥品生(shēng)産許可(kě)證》分(fēn)類碼應當包含标識B,且具備相(xiàng)應委托生(shēng)産範圍,并應當包含受托生(shēng)産企業(yè)的(de)生(shēng)産地(dì)址。↕
2.1.2 境外(wài)申請(qǐng)人(rén)指定中國(guó)境內(nèi)的(de)企業(yè)法人(rén)辦理(lǐ)相(xiàng)關藥品注冊事(s¶hì)項的(de),應當提供授權委托文(wén)書(shū)、公證文(wén)書(shū)及中文(wén)譯文(wén),以及注冊代理(lǐ↕)機(jī)構的(de)營業(yè)執照(zhào)。上(shàng)市(shì)許可(kě)申請(qǐng)時δ(shí),如(rú)變更注冊代理(lǐ)機(jī)構,還(hái)應當提交境外(wài)申請(qǐng)人(rén)解除原委托代理(lǐ)注冊關系的(d↕e)文(wén)書(shū)、公證文(wén)書(shū)及中文(wén)譯文(wén)。
2.2 生(shēng)産企業(yè)資質證明(míng)文(wén)件(jiàn)
2.2.1 境內(nèi)生(shēng)産企業(yè)機(jī)構合法登記證明(míng)文(wén)件(jiàn)(營業(yè)執照(zhào)等)、相(xiàng)應的(de)《藥品生(s©hēng)産許可(kě)證》及變更記錄頁(适用(yòng)于上(shàng)市(shì)許可(kě)申請(qǐng))。 《藥品生(shēng)産許可(kě)證》中,申報(bào)藥品所在的(de)生(shēng)産線應當具備相(xiàng)應生(shēng)産範圍。對(duì)于企業(yè)新建生(shēng)産線或生(shēng)産線新增生(shēng)産範圍,且尚未完成相(xiàng)關程序列入《藥品生(shēng)産許可(kě)σ證》中的(de),《藥品生(shēng)産許可(kě)證》變更記錄中應當載明(míng)相(xiàng)應生(s hēng)産線變更信息及省局初步審核意見(jiàn),或提供省局出具或認可(kě)的(de)其他(tā)證明(míng)材料。 受托生(shēng)産企業(yè)《藥品生(shēng)産許可(kě)證》分(fēn)類碼應當包含标識C且具備相(xiàng)應受托生(shēng)産範圍。 申請(qǐng)臨床試驗的(de),應當提供申請(qǐng)人(rén)出具的(de)其臨床試驗用(yòng)藥物(wù)在符合藥品生(shēng)産質量管理(lǐ)規範的(de)條件(jiàn)下(xià)制(zhì)備的(de)情況說(shuō)明(míng)。
2.2.2 境外(wài)藥品管理(lǐ)機(jī)構出具的(de)該藥品生(shēng)産廠(chǎng)和(hé)包裝廠(chǎng)符合藥品生(shēng)産質量管理φ(lǐ)規範的(de)證明(míng)文(wén)件(jiàn)、公證認證文(wén)書(shū)及中文(wén)譯文(wén)(适用(yòng♦)于境外(wài)生(shēng)産藥品)。 對(duì)于生(shēng)産國(guó)家(jiā)或地(dì)區(qū)按食品管理(lǐ)的(de)制(zhì)劑,應當提供該國(guó)家(j×iā)或地(dì)區(qū)藥品管理(lǐ)機(jī)構出具的(de)該生(shēng)産企業(yè)符合藥品生(shēng)産質量管理(lǐ)規範的(de)證明(míng)文(σwén)件(jiàn),或有(yǒu)關機(jī)構出具的(de)該生(shēng)産企業(yè)符合ISO 9000 質量管理(lǐ)體(tǐ)系的(de)證明(míng)文(wén)件(jiàn)。對(duì)于生(shēng)産國(guó)家(jiā)或地(dì)區(qū)按醫←(yī)療器(qì)械管理(lǐ)的(de)制(zhì)劑,應當提供企業(yè)資格證明(míng)文(wén)件(jiàn)。 申請(qǐng)新藥臨床試驗的(de),應當提供申請(qǐng)人(rén)出具的(de)其臨床試驗用(yòng)藥物(×wù)在符合藥品生(shēng)産質量管理(lǐ)規範的(de)條件(jiàn)下(xià)制(zhì)備的(de)情況說(shuō)明(míng)。
2.3 小(xiǎo)微(wēi)企業(yè)證明(míng)文(wén)件(jiàn)(如(rú)适用(yòng)):企業(yè)的(de)工(gōng)商營業(yè)執照(zhào)β副本;上(shàng)一(yī)年(nián)度企業(yè)所得(de)稅納稅申報(bào)表(須經 稅務部門(mén)蓋章(zhāng)确認)或上(shàng)一(yī)年(nián)度有(yǒu)效統計(jì)表(統計(jì♣)部門(mén)出具)。
3.其他(tā)申報(bào)資料
3.1 注冊分(fēn)類及依據 申請(qǐng)人(rén)應當按照(zhào)《中藥注冊分(fēn)類及申報(bào)資料要(yào)求》明(míng)确注冊分(fēn)類,并在“行(xíng)政 文(wén)件(jiàn)和(hé)藥品信息”說(shuō)明(míng)函中說(shuō)明(míng)分(fēn)類依據。 中藥創新藥應當明(míng)确處方未在國(guó)家(jiā)藥品标準、藥品注冊标準及國(guó)家(jiā)中醫(yī)藥主管部門(mén)發布的(de←)《古代經典名方目錄》中收載,具有(yǒu)臨床價值,且未在境外(wài)上(shàng)市(shì)。
3.1.1 珍稀瀕危中藥材替代品上(shàng)市(shì)許可(kě)申請(qǐng),除已有(yǒu)國(guó)家(ji→ā)藥品标準的(de)珍稀瀕危中藥材替代品研制(zhì),按照(zhào)中藥注冊分(fēn)類中“其他(tā)情形”進行(xíng)申報(bào)外(wài),新研制(zh∞ì)的(de)珍稀瀕危中藥材替代品,按照(zhào)“1.3新藥材及其制(zhì)劑”注冊類别進行(xíng)申報(bào)。
3.1.2 中藥增加功能(néng)主治是(shì)指增加新的(de)主治病證或原主治病證下(xià)新的(de)治療目标等;或原功能(néng)主治為(w èi)中醫(yī)術(shù)語表述,改良後拟新增用(yòng)于現(xiàn)代醫(yī)學疾病的(de)适應症。
3.2 臨床試驗報(bào)告應當符合相(xiàng)關技(jì)術(shù)指導原則要(yào)求,臨床試驗報(bào)告标題頁應當提供藥品注冊申請(qǐng)人(↑rén)(簽字及蓋章(zhāng)),主要(yào)或協調研究者(簽字)、負責或協調研究單位名稱、統計(jì)學負責<人(rén)(簽字)和(hé)統計(jì)單位名稱及ICH E3 要(yào)求的(de)其他(tā)信息;臨床試驗報(bào)告附錄II中應當提供申辦方負責醫(yī)學專員(yuán)簽名。臨床試驗數(shù)據庫電(diàn)子(zǐ)文(wén)件(jiàn):應為(wèi)SAS XPORT傳輸格式(即xpt格式),随全套電(diàn)子(zǐ)申報(bào)資料一(yī)并提交。
3.3 拟使用(yòng)的(de)藥品通(tōng)用(yòng)名稱,未列入國(guó)家(jiā)藥品标準或者藥品注冊标♦準的(de),應當在提出藥品上(shàng)市(shì)許可(kě)申請(qǐng)時(shí)同時(shí)提出通(tōn≥g)用(yòng)名稱核準申請(qǐng),并提交通(tōng)用(yòng)名稱核準相(xiàng)關資料。
3.4 拟申報(bào)注冊的(de)藥械組合産品,已有(yǒu)同類産品經屬性界定為(wèi)藥品的(de),按照(zhào)藥品進行(xíng)申報(bào);尚≤未經屬性界定的(de),申請(qǐng)人(rén)應當在申報(bào)注冊前向國(guó)家(jiā)藥品監督管理(lǐ)局申請(qǐng→)産品屬性界定。屬性界定為(wèi)藥品為(wèi)主的(de),按照(zhào)《藥品注冊管理(lǐ)辦法》規定的(de)程序進行(xíng)注冊,其中醫(yī)療器(qì)械部分£(fēn)參照(zhào)醫(yī)療器(qì)械注冊申報(bào)資料要(yào)求提交,單獨準備光(guāng)盤。
3.5 根據《藥品注冊管理(lǐ)辦法》第三十四條要(yào)求,藥品上(shàng)市(shì)注冊申請(qǐng)時(shí)應當完成商業(yè)規模生(≥shēng)産工(gōng)藝驗證。申報(bào)資料中應當提交工(gōng)藝驗證方案和(hé)工(gōng)藝驗證報(bào)告。
3.6 申請(qǐng)人(rén)撤回注冊申請(qǐng)後重新申報(bào)的(de),應當對(duì)重新開≤(kāi)展或者補充完善的(de)相(xiàng)關情況進行(xíng)詳細說(shuō)明(míng)。
(五)其他(tā)提示
1.麻醉藥品、精神藥品、醫(yī)療用(yòng)毒性藥品、藥品類易制(zhì)毒化(huà)學品不(bù)得(de)委托生(sh↓ēng)産;含麻醉藥品複方制(zhì)劑、含精神藥品複方制(zhì)劑以及含藥品類易制(zhì)毒化(huà)學品複方制(zhì)劑不(bù)得(de)委托生(shēng)産。但(dàn)是(shì),國(guó)務院藥品監督管理(lǐ)部門(mén)另有(yǒu)規定的(de)除外(wài)。
2.注冊分(fēn)類3.1類的(de)注冊申請(qǐng)人(rén)應當為(wèi)中國(guó)境內(nèi)依法設立,能(néng)夠承擔α相(xiàng)應法律責任的(de)企業(yè)或者藥品研制(zhì)機(jī)構等。
3.古代經典名方中藥複方制(zhì)劑申請(qǐng)上(shàng)市(shì)時(shí),申請(qǐ↔ng)人(rén)如(rú)有(yǒu)滾動提交毒理(lǐ)研究資料的(de)需求,應在申請(qǐng)表“其他(tā)特别申明(míng)事(shì)項”及申≤報(bào)資料中予以聲明(míng),并在聲明(míng)中寫明(míng)拟提交滾動資料的(de)最終時(shí)限(最晚應在審評時(shí)限屆滿六≈十日(rì)前提交)。
4.境外(wài)生(shēng)産的(de)藥品所提交的(de)境外(wài)藥品管理(lǐ)機(jī)構出具的(de)證明(míng)文β(wén)件(jiàn)(包括允許藥品上(shàng)市(shì)銷售證明(míng)文(wén)件(jiàn)、符合藥品生(sh¥ēng)産質量管理(lǐ)規範證明(míng)文(wén)件(jiàn)以及允許藥品變更證明(míng)文(wén)件(jiàn)™等),為(wèi)符合世界衛生(shēng)組織推薦的(de)統一(yī)格式原件(jiàn)的(de),可(kě)不(bù)經所在國(guó)公λ證機(jī)構公證及駐所在國(guó)中國(guó)使領館認證。《取消外(wài)國(guó)公文(wé♣n)書(shū)認證要(yào)求的(de)公約》締約國(guó)出具的(de)上(shàng)述文(wén)件(jiàn),隻需辦理(lǐ)該國(guó)附加證明(míng∑)書(shū),無需辦理(lǐ)該國(guó)和(hé)中國(guó)駐當地(dì)使領館的(de)領事(shì)認證;但(dàn)是(shì),外(wài)交部公布的(de)《取消外(wài↔)國(guó)公文(wén)書(shū)認證要(yào)求的(de)公約》締約國(guó)名單注釋中注明(mí≠ng)不(bù)适用(yòng)的(de)除外(wài)。
5.在已獲準開(kāi)展的(de)臨床試驗期間(jiān),提出新增功能(néng)主治(或者适應症)臨床試驗申請(qǐng)的(de),申請(qǐng)時(shí)與首次申請(qǐn☆g)重複的(de)資料可(kě)免于提交(行(xíng)政文(wén)件(jiàn)和(hé)藥品信息除外(wài)),但(dàn)應當在申報(bào)資料中列出首次申請(qǐng)中相(xiàngσ)關資料的(de)編号。
6.屬于簡化(huà)港澳已上(shàng)市(shì)傳統口服中成藥內(nèi)地(dì)上(shàng)市(shì)注冊審批情形的(de),申報(bào)資₽料應當按照(zhào)《簡化(huà)港澳已上(shàng)市(shì)傳統口服中成藥內(nèi)地(dì)上(shàng)市(shì)注冊審批申報(bào)資料及技(jì)術(shù)要(♠yào)求》整理(lǐ)。
7.創新藥臨床試驗申請(qǐng)申報(bào)資料要(yào)求應當符合相(xiàng)關要(yào)求。
五、受理(lǐ)審查決定
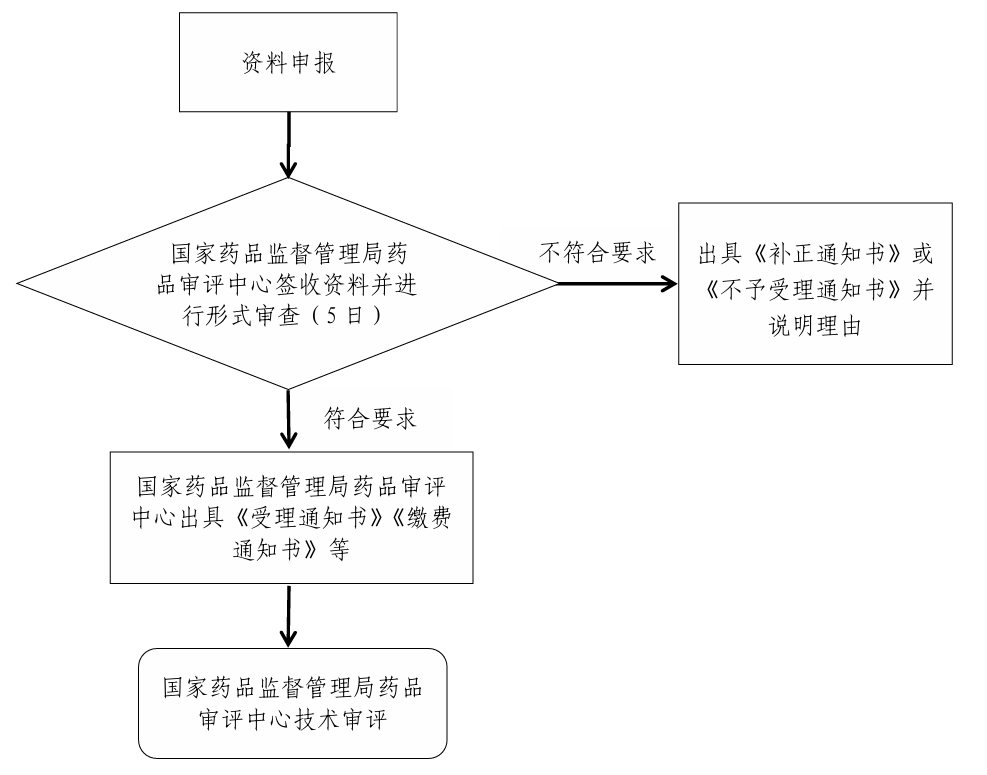
(一(yī))受理(lǐ)
1. 受理(lǐ)通(tōng)知(zhī)書(shū):符合形式審查要(yào)求的(de),出具《受理(lǐ)通(tōng)知(zhī)書(shū)》。
2. 繳費(fèi)通(tōng)知(zhī)書(shū):需要(yào)繳費(fèi)的(de),出具《繳費(fèi)通(tōn↓g)知(zhī)書(shū)》。
(二)補正
申報(bào)資料不(bù)齊全或者不(bù)符合法定形式的(de),應當一(yī)次告知(zhī)申請(qǐn®g)人(rén)需要(yào)補正的(de)全部內(nèi)容,出具《補正通(tōng)知(zhī)書(shū)》。
(三)不(bù)予受理(lǐ)
不(bù)符合要(yào)求的(de),出具《不(bù)予受理(lǐ)通(tōng)知(zhī)書(shū)》,并說(shuō)明(míng)理(lǐ)由。
(四)受理(lǐ)流程圖
六、其他(tā)
其他(tā)未盡事(shì)宜,請(qǐng)參照(zhào)《藥品注冊管理(lǐ)辦法》《中藥注冊分(fēn)類及申報(bào)資料要(yào)求》等現Ω(xiàn)行(xíng)的(de)規定及技(jì)術(shù)指導原則等有(yǒu)關文(wén)件(jià÷n)執行(xíng)。國(guó)家(jiā)藥品監督管理(lǐ)局藥品審評中心2020年(nián)10月(yuè)22 日(rì)發布的(de)《中藥注冊受理(lǐ)審查指南(nán)(試行(xíng))》(2020年(nián)第34号)同時(shí)廢止。
七、附件(jiàn)
1.中藥注冊申報(bào)資料自(zì)查表
2.參考目錄