第一(yī)章(zhāng) 藥品注冊申請(qǐng)受理(lǐ)情況
(一(yī))總體(tǐ)情況
2023年(nián),藥品注冊申請(qǐng)申報(bào)量持續增長(cháng), 藥審中心受理(lǐ)各類注 冊申請(qǐng) 18503 件(jiàn)(同比增加 35.84%,以受理(lǐ)号計(jì), 下(xià)同),包括藥品 制(zhì)劑注冊申請(qǐng) 16898 件(jiàn)(同比增加36.63%),化(huà)學原料藥注冊申請(qǐng) 1605 件(jiàn)(同比增加 28.09%)。 16898 件(jiàn)藥品制(zhì)劑注冊申請(qǐng)包括技(jì)術(shù)審評類 注冊申請(qǐng) 13153 件(jiàn)(同比增加 41.41%,包括 13144 件(jiàn)藥品, 9 件(jiàn)藥械 組合),直接行(xíng)政審批類注冊申請(qǐng) 3745 件(jiàn)(同比增加 22.11%,包括補充申請(qǐng)和(hé)一(yī)次性進口)。2019 年(nián)至2023 年(nián)注冊申請(qǐng)受理(lǐ)情況詳見(jiàn)圖1。
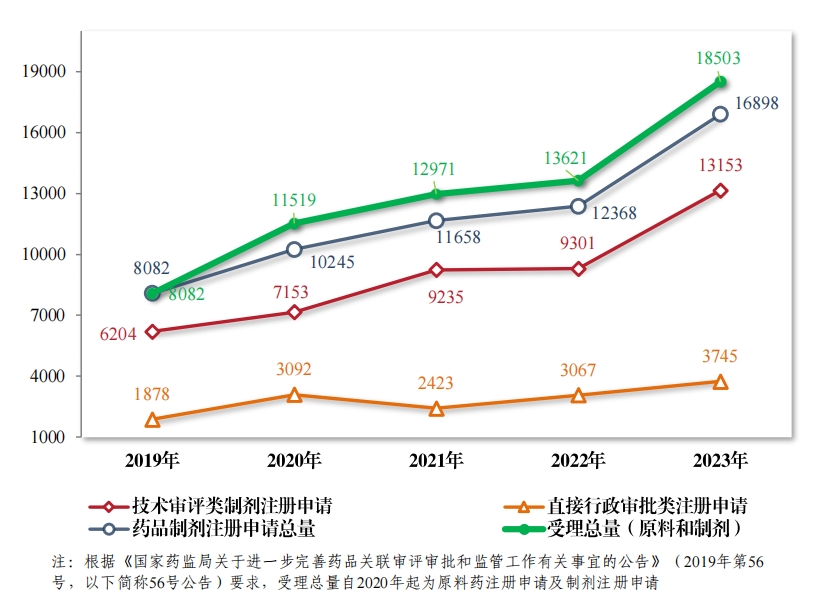
(二)技(jì)術(shù)審評類藥品注冊申請(qǐng)受理(lǐ)情況
2023 年(nián)受理(lǐ)的(de) 13144 件(jiàn)技(jì)術(shù)審評類藥品注冊申請(qǐng)中, 以藥品類 型統計(jì), 中藥注冊申請(qǐng)$ 1163 件(jiàn),同比增加 176.25%;化(huà)學藥品注冊 申請(qǐng) 9813 件(jiàn), 同比增加 39.11%,占全部需技(jì)術(shù)審評的(de)藥品注冊申 請(qǐng)受理(lǐ)量的(de) 74.66%;生(shēng)物(wù)制(zhì)品注冊申請(qǐng) 2168 件(jiàn), 同比增加 19.12%。2019 年(nián)至 2023 年(nián)需技(jì)術(shù)審評的(de)各藥品類型注冊申請(qǐng)受理(lǐ)情況詳見(jiàn)圖2。
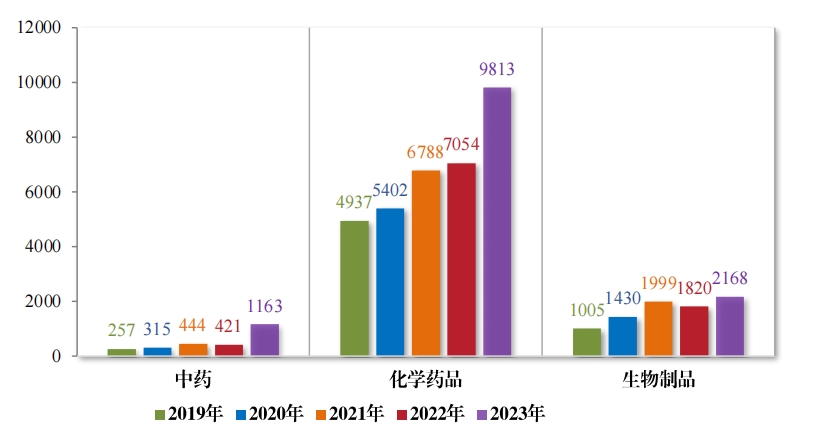
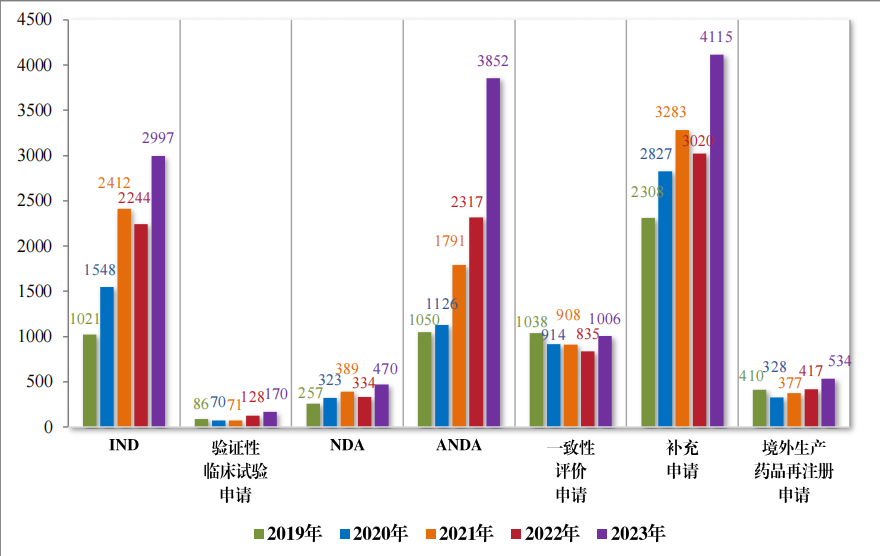
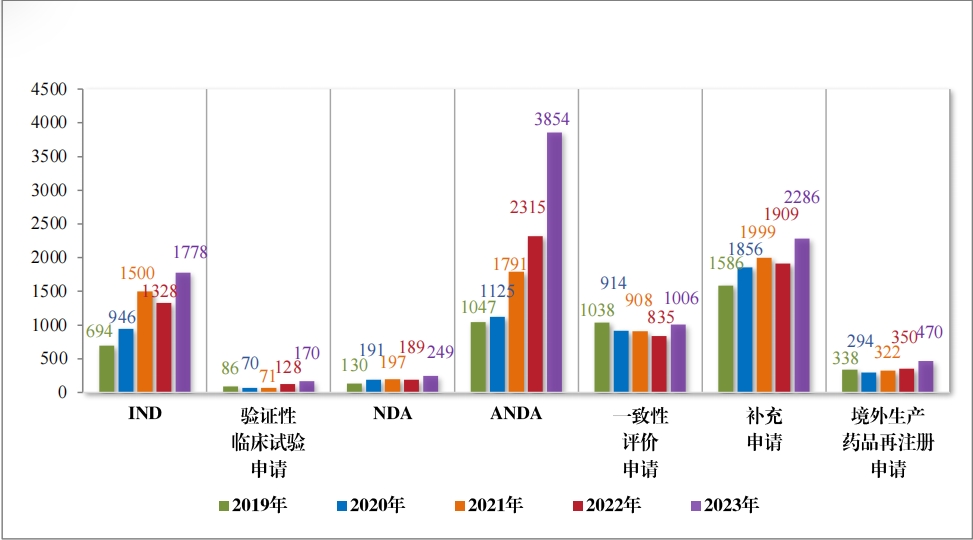
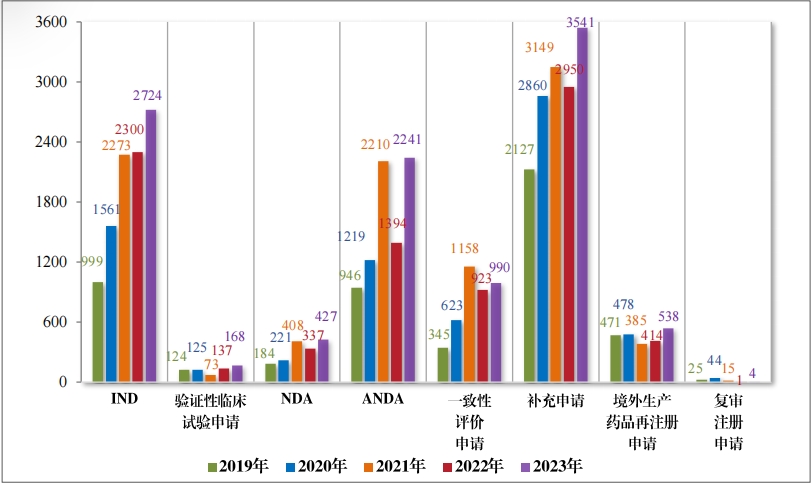
以注冊申請(qǐng)類别統計(jì),受理(lǐ)新藥臨床試驗申請(qǐng)(該注冊申請(qǐng)類别 以下(xià)簡稱“IND”)2997 件(jiàn),同比增加 33.56%;驗證性臨床試驗申請(qǐng) 170 件(jiàn), 比 2022 年(nián)增加 32.81%;新藥上(shàng)市(shì)許可(kě)申請(qǐng)(該注冊申請(qǐng)類 别以下(xià)簡稱“NDA”)470 件(jiàn),同比增加 40.72%;同名同方藥、化(huà)學仿 制(zhì)藥上(shàng)市(shì)許可(kě)申請(qǐng)(該注冊申請(qǐng)類别以下(xià)簡稱“ANDA”)3852 件(jiàn),同 比增加 66.25%;仿制(zhì)藥質量和(hé)療效一(yī)緻性評價注冊申請(qǐng)(該注冊申 請(qǐng)類别以下(xià)簡稱“ 一(yī)緻性評價申請(qǐng)” )1006 件(jiàn),同比增加 20.48%;補 充申請(qǐng) 4115 件(jiàn),同比增加 36.26%;境外(wài)生(shēng)産藥品再注冊申請(qǐng) 534 件(jiàn), 同比增加 28.06%。2019 年(nián)至 2023 年(nián)需技(jì)術(shù)審評的(de)各類别注冊申請(qǐng)受理(lǐ)情況詳見(jiàn)圖 3。
1.中藥注冊申請(qǐng)受理(lǐ)情況
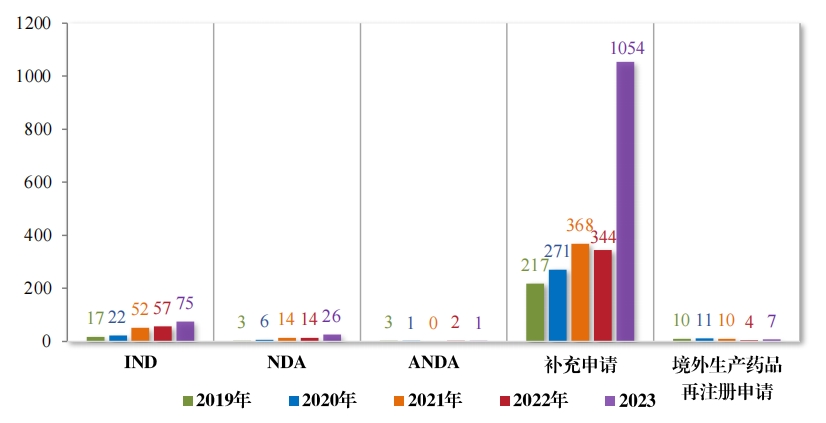
2023 年(nián)受理(lǐ)中藥注冊申請(qǐng) 1163 件(jiàn)。按審評序列統計(jì),IND 75 件(jiàn), 同比增加 31.58%;NDA 26 件(jiàn),同比增加 85.71%;補充申請(qǐng) 1054 件(jiàn), 同比增加 206.40%;ANDA 1 件(jiàn),進口再注冊 7 件(jiàn), 與去(qù)年(nián)持平。2019年(nián)至 2023 年(nián)需技(jì)術(shù)審評的(de)中藥各類别注冊申請(qǐng)受理(lǐ)情況詳見(jiàn)圖 4。
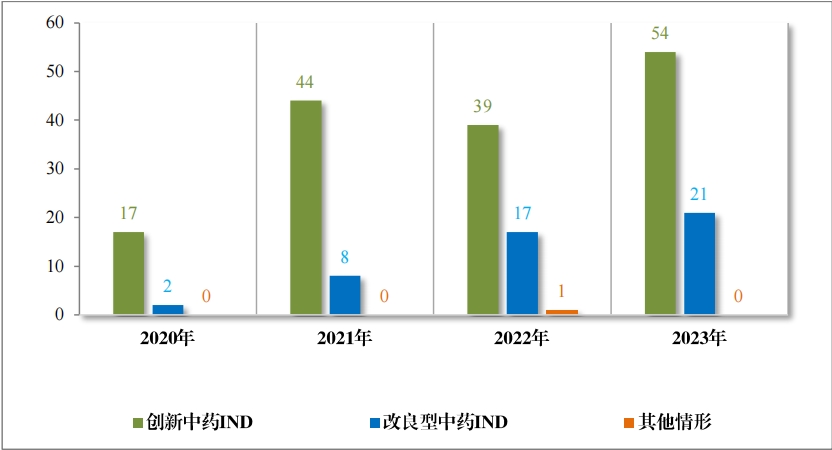
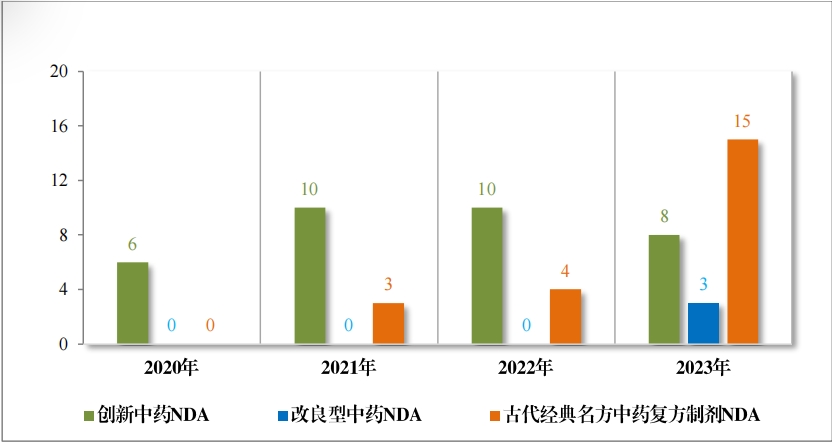
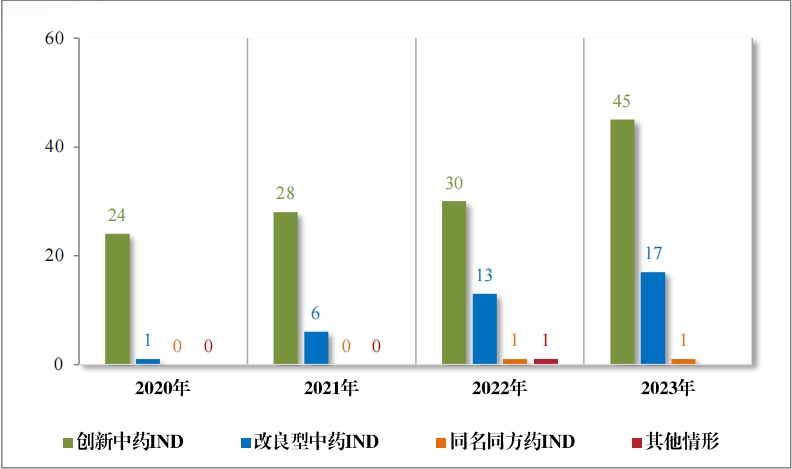
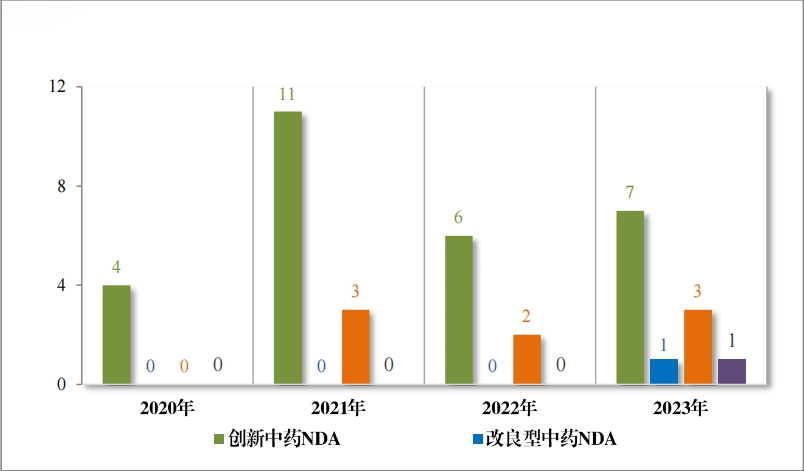
以注冊分(fēn)類統計(jì),IND 75 件(jiàn), 包括創新中藥 IND 54 件(jiàn)(47 個(gè)品 種),同比增加 38.46%;改良型中藥 IND 21 件(jiàn)(21 個(gè)品種),同比增 加 23.53%。NDA 26 件(jiàn), 包括創新中藥 NDA 8 件(jiàn)(7 個(gè)品種),與去(qù) 年(nián)持平; 改良新中藥 NDA3 件(jiàn)(3 個(gè)品種);古代經典名方中藥複方制(zhì)劑 NDA 15 件(jiàn)(11 個(gè)品種),同比增加 275.00%。
2023 年(nián)各注冊分(fēn)類中藥 IND 、NDA 受理(lǐ)情況詳見(jiàn)表 1 ,2020 年(nián) 至 2023 年(nián)各注冊分(fēn)類中藥 IND 受理(lǐ)情況詳見(jiàn)圖 5 ,2020 年(nián)至 2023年(nián)各注冊分(fēn)類中藥 NDA 受理(lǐ)情況詳見(jiàn)圖 6。
2.化(huà)學藥品注冊申請(qǐng)受理(lǐ)情況
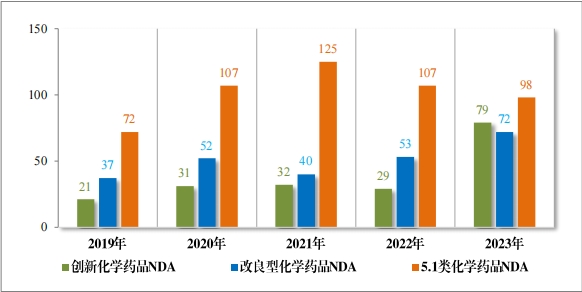
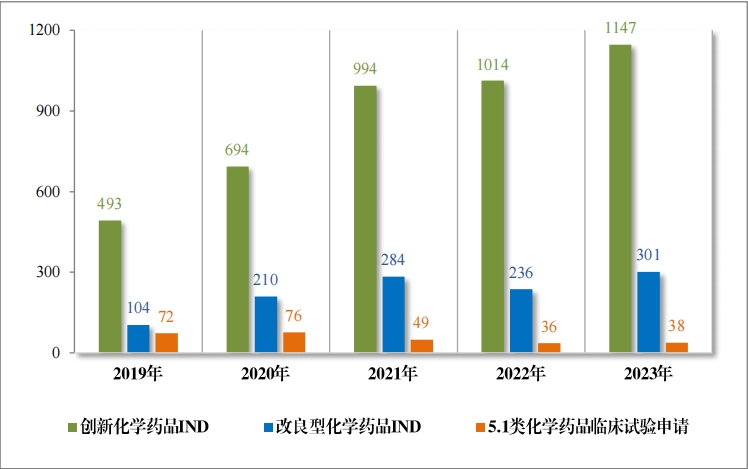
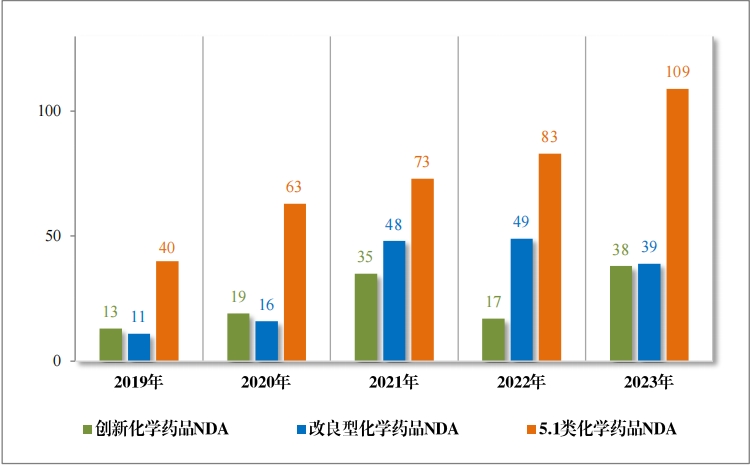
2023 年(nián)受理(lǐ)需技(jì)術(shù)審評的(de)化(huà)學藥品注冊申請(qǐng) 9813 件(jiàn)。按審評序 列統計(jì),IND 1778 件(jiàn),同比增加 66.48%;NDA 249 件(jiàn),同比增加 31.75%;ANDA 3851 件(jiàn),同比增加 66.35%;一(yī)緻性評價申請(qǐng) 1006 件(jiàn),同比增加 20.48%。5.1 類化(huà)學藥品1注冊申請(qǐng) 130 件(jiàn),同比減少(shǎo) 10.96% , 其中驗證性臨床試驗申請(qǐng)2共 32 件(jiàn), NDA 98 件(jiàn)。 2019 年(nián)至 2023 年(nián)需技(jì)術(shù)審評的(de)化(huà)學藥品各類别注冊申請(qǐng)受理(lǐ)情況詳見(jiàn)圖 7。
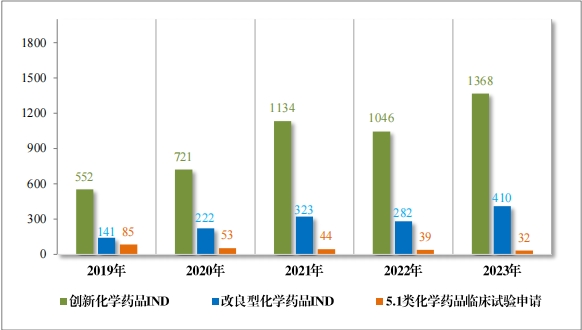
1778 件(jiàn) IND中,包括創新化(huà)學藥品 IND 1368 件(jiàn)(600 個(gè)品種), 同比增加 30.78%;改良型化(huà)學藥品 IND 410 件(jiàn)(229 個(gè)品種),同比 增加 45.39%。NDA 249 件(jiàn)中, 包括創新化(huà)學藥品 NDA 79 件(jiàn)(55 個(gè) 品種),同比增加 172.41%;改良型化(huà)學藥品 NDA 72 件(jiàn)(46 個(gè)品種), 同比增加 35.85%;5.1 類化(huà)學藥品 NDA 98 件(jiàn)(62 個(gè)品種), 同比減少(shǎo) 8.41%。
2023 年(nián)各注冊分(fēn)類化(huà)學藥品 IND、NDA 受理(lǐ)情況詳見(jiàn)表 2,2019 年(nián)至 2023 年(nián)各注冊分(fēn)類化(huà)學藥品臨床試驗申請(qǐng)受理(lǐ)情況詳見(jiàn)圖 8,2019 年(nián)至 2023 年(nián)各注冊分(fēn)類化(huà)學藥品 NDA 受理(lǐ)情況詳見(jiàn)圖 9。
3.生(shēng)物(wù)制(zhì)品注冊申請(qǐng)受理(lǐ)情況
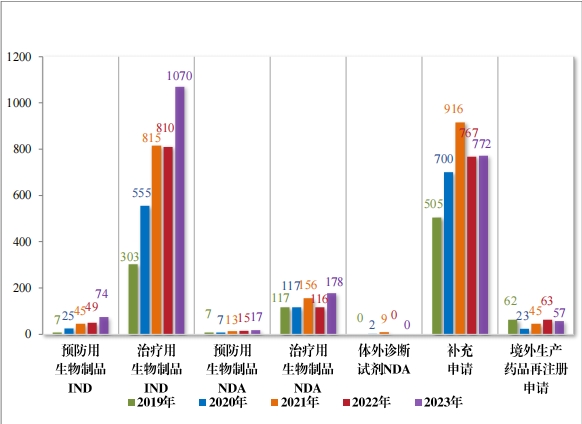
2023 年(nián)受理(lǐ)生(shēng)物(wù)制(zhì)品注冊申請(qǐng) 2168 件(jiàn),其中, 預防用(yòng)生(shēng)物(wù)制(zhì)品 注冊申請(qǐng) 189 件(jiàn)、治療用(yòng)生(shēng)物(wù)制(zhì)品注冊申請(qǐng) 1969 件(jiàn)和(hé)體(tǐ)外(wài)診斷試劑10 件(jiàn)。
以注冊申請(qǐng)類别統計(jì), IND 1144 件(jiàn), 同比增加 33.18%;NDA 195 件(jiàn),同比增加 48.85%;補充申請(qǐng) 772 件(jiàn),同比增加 0.65%;境外(wài)生(shēng)産藥品再注冊申請(qǐng) 57 件(jiàn),同比減少(shǎo) 9.52%。2019 年(nián)至 2023 年(nián)需技(jì)術(shù)審評的(de)生(shēng)物(wù)制(zhì)品各類别注冊申請(qǐng)受理(lǐ)情況詳見(jiàn)圖 10。
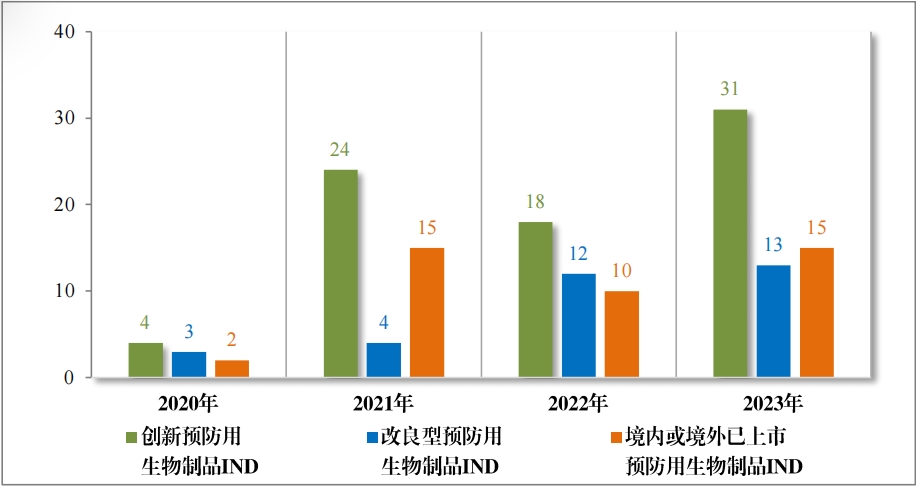
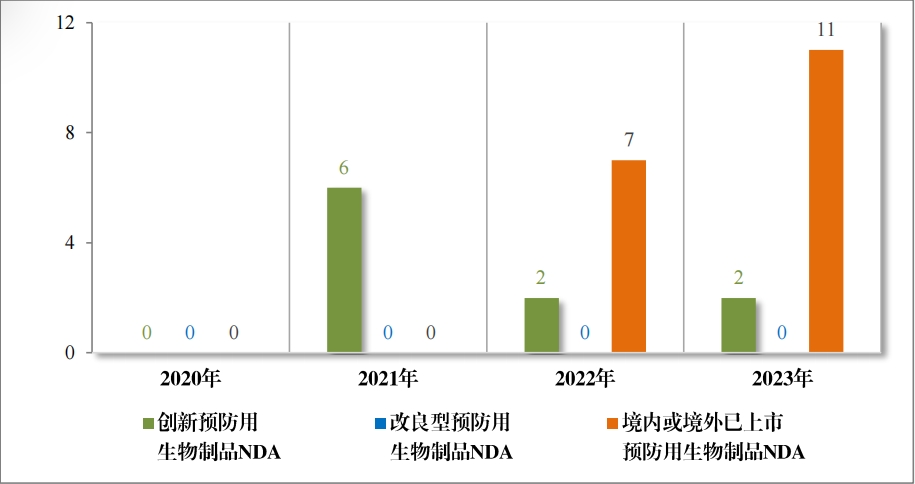
以注冊分(fēn)類統計(jì),預防用(yòng)生(shēng)物(wù)制(zhì)品 IND 74 件(jiàn),包括創新預防用(yòng) 生(shēng)物(wù)制(zhì)品 IND 43 件(jiàn)(34 個(gè)品種), 同比增加 104.76% ;改良型預防 用(yòng)生(shēng)物(wù)制(zhì)品 IND13 件(jiàn)(11 個(gè)品種),同比減少(shǎo) 18.75% ;境內(nèi)或境外(wài) 已上(shàng)市(shì)預防用(yòng)生(shēng)物(wù)制(zhì)品 IND 18 件(jiàn)(11 個(gè)品種), 同比增加 50.00% 。 預防用(yòng)生(shēng)物(wù)制(zhì)品 NDA 17 件(jiàn), 包括創新預防用(yòng)生(shēng)物(wù)制(zhì)品 NDA 1 件(jiàn)(1 個(gè)品種);改良型預防用(yòng)生(shēng)物(wù)制(zhì)品 NDA 2 件(jiàn)(2 個(gè)品種);境內(nèi)或境外(wài)已上(shàng)市(shì)預防用(yòng)生(shēng)物(wù)制(zhì)品 NDA 14 件(jiàn)(6 個(gè)品種)。
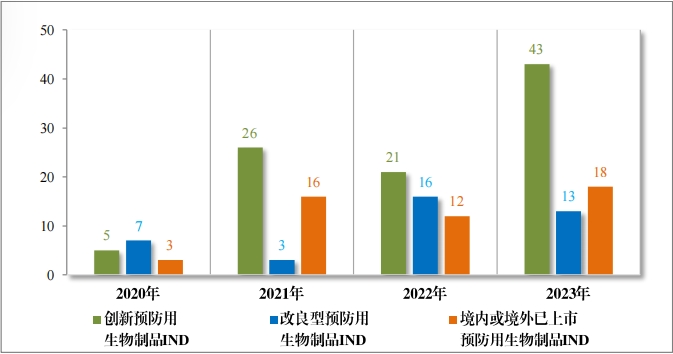
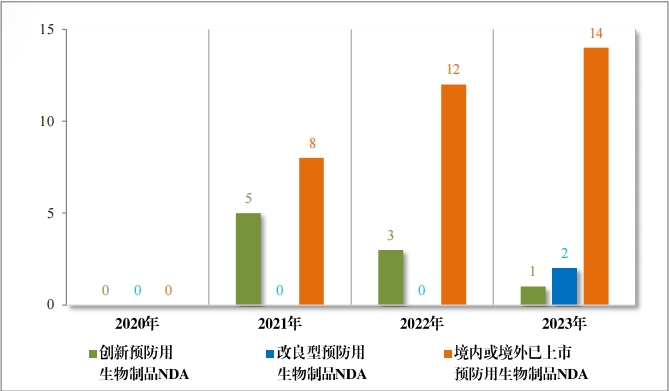
2023 年(nián)各注冊分(fēn)類預防用(yòng)生(shēng)物(wù)制(zhì)品 IND 、NDA 受理(lǐ)情況詳見(jiàn)表 3 ,2020 年(nián)至 2023 年(nián)各注冊分(fēn)類預防用(yòng)生(shēng)物(wù)制(zhì)品 IND 受理(lǐ)情況詳見(jiàn) 圖 11 ,2020 年(nián)至 2023 年(nián)各注冊分(fēn)類預防用(yòng)生(shēng)物(wù)制(zhì)品 NDA 受理(lǐ)情況詳見(jiàn)圖 12。
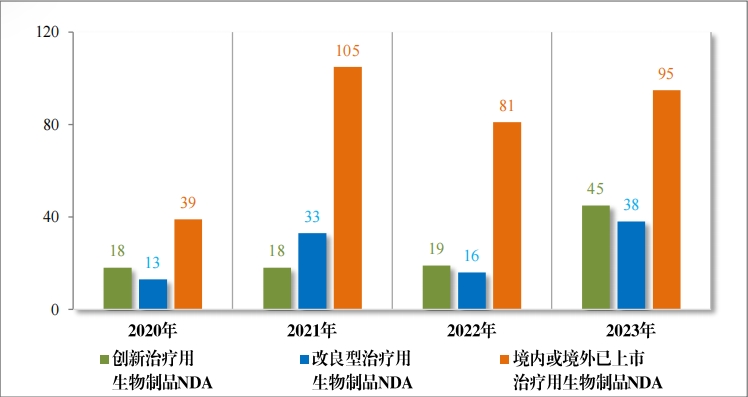
治療用(yòng)生(shēng)物(wù)制(zhì)品 IND 1070 件(jiàn),包括創新治療用(yòng)生(shēng)物(wù)制(zhì)品 IND 833 件(jiàn)(576 個(gè)品種),同比增加 32.85%;改良型治療用(yòng)生(shēng)物(wù)制(zhì)品 IND146 件(jiàn)(75 個(gè)品種),同比增加 39.05%;境內(nèi)或境外(wài)已上(shàng)市(shì)治療用(yòng)生(shēng)物(wù)制(zhìβ)品 IND 91 件(jiàn)(46 個(gè)品種),同比增加 16.67%。
治療用(yòng)生(shēng)物(wù)制(zhì)品 NDA 178 件(jiàn),包括創新治療用(yòng)生(shēng)物(wù)制(zhì)品 NDA 45 件(jiàn)(29 個(gè)品種),同比增加 136.84%;改良型治療用(yòng)生(shēng)物(wù)制(zhì)品 NDA 38 件(jiàn)(18 個(gè)品種), 同比增加 137.50%;境內(nèi)或境外(wài)已上(shàng)市(shì)治療用(yòng)生(shēng)物(wù)制(zhì)品 NDA 95 件(jiàn)(58 個(gè)品種),同比增加 17.28%。
2023 年(nián)各注冊分(fēn)類治療用(yòng)生(shēng)物(wù)制(zhì)品 IND 、NDA 受理(lǐ)情況詳見(jiàn)表 4 ,2020 年(nián)至 2023 年(nián)各注冊分(fēn)類治療用(yòng)生(shēng)物(wù)制(zhì)品 IND 受理(lǐ)情況詳見(jiàn) 圖 14 ,2020 年(nián)至 2023 年(nián)各注冊分(fēn)類治療用(yòng)生(shēng)物(wù)制(zhì)品 NDA 受理(lǐ)情況詳見(jiàn)圖 15。
(三)直接行(xíng)政審批類注冊申請(qǐng)受理(lǐ)情況
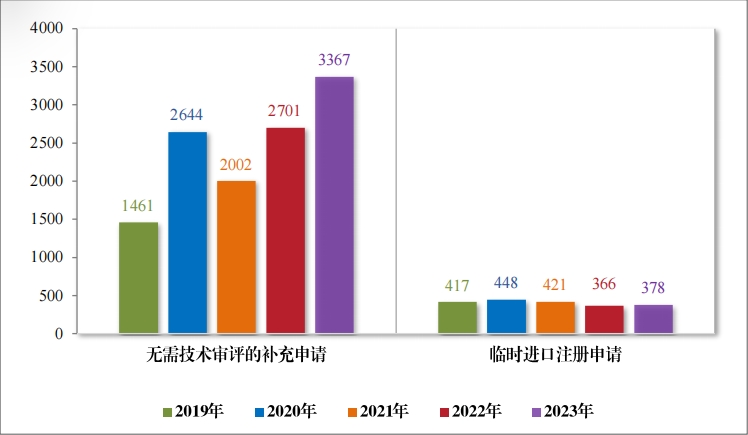
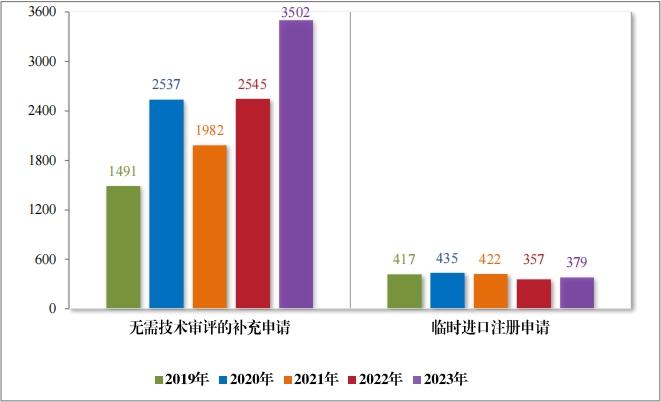
2023 年(nián)受理(lǐ)直接行(xíng)政審批類注冊申請(qǐng) 3745 件(jiàn),同比增加22.11%; 包括無需技(jì)術(shù)審評的(de)補充申請(qǐng) 3367 件(jiàn),同比增加 24.66%;臨時(shí)進口 注冊申請(qǐng) 378 件(jiàn),同比增加 3.28%。2019 年(nián)至 2023 年(nián)直接審批的(de)各類别注冊申請(qǐng)受理(lǐ)情況詳見(jiàn)圖 16。
第二章(zhāng) 藥品注冊申請(qǐng)審評審批情況
(一(yī))總體(tǐ)情況
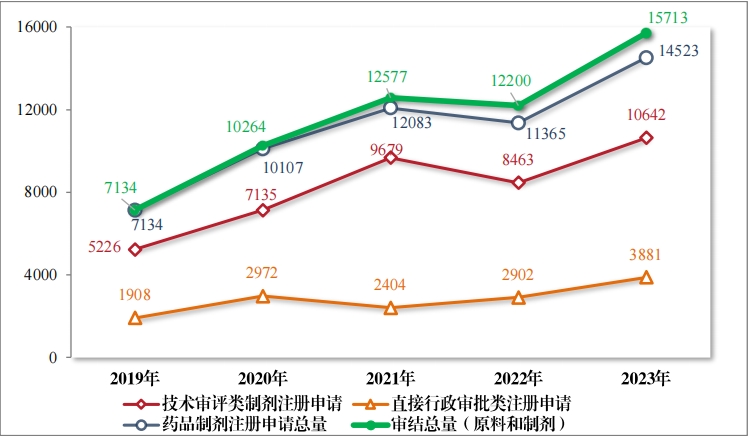
2023 年(nián),藥審中心審結3注冊申請(qǐng)共 15713 件(jiàn)(同比增加 28.80%), 包括藥品制(zhì)劑注冊申請(qǐng) 14523 件(jiàn)(同比增加 27.79%),化(huà)學原料藥注 冊申請(qǐng) 1190 件(jiàn)(同比增加 42.51%)。14523 件(jiàn)藥品制(zhì)劑注冊申請(qǐng)包含 技(jì)術(shù)審評類注冊申請(qǐng) 10642 件(jiàn)(同比增加 25.75%,包括 10633 件(jiàn)藥 品, 9 件(jiàn)藥械組合),直接行(xíng)政審批類注冊申請(qǐng) 3881 件(jiàn)(同比增加33.74%)。2019 年(nián)至 2023 年(nián)注冊申請(qǐng)審結量詳見(jiàn)圖 16。

截至 2023 年(nián)底, 在審和(hé)待審的(de)注冊申請(qǐng)共 11059 件(jiàn),其中包含 原料藥注冊申請(qǐng) 2148 件(jiàn);待申請(qǐng)人(rén)回複補充資料的(de)注冊申請(qǐng)共 2153件(jiàn),其中包含原料藥注冊申請(qǐng) 622 件(jiàn)。
(二)技(jì)術(shù)審評類注冊申請(qǐng)審結情況
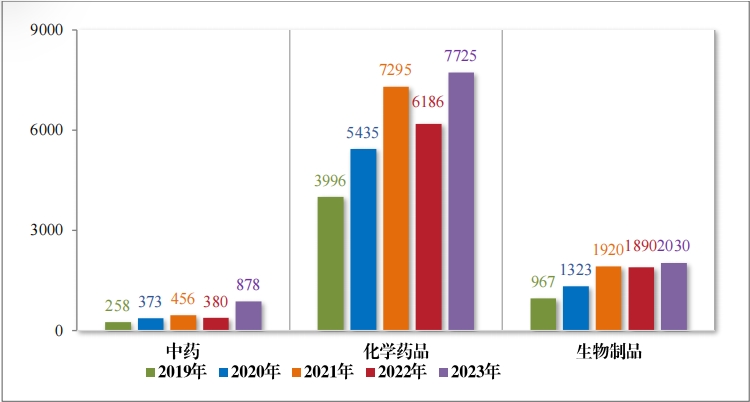
2023 年(nián)審結的(de) 10642 件(jiàn)技(jì)術(shù)審評類注冊申請(qǐng)中,按藥品類型計(jì), 中藥注冊申請(qǐng) 878 件(jiàn), 同比增加 131.05%;化(huà)學藥品注冊申請(qǐng) 7725 件(jiàn),同比增加 24.88%,占全部需技(jì)術(shù)審評審結量的(de) 72.59%;生(shēng)物(wù)制(zhì) 品注冊申請(qǐng) 2030 件(jiàn) ,同比增加 7.41%;藥械組合注冊申請(qǐng) 9 件(jiàn)。2019年(nián)至 2023 年(nián)需技(jì)術(shù)審評的(de)各藥品類型注冊申請(qǐng)審結情況詳見(jiàn)圖 17。
按審評序列計(jì),2023 年(nián)審結 IND 2724 件(jiàn), 同比增加 18.43%;驗 證性臨床試驗申請(qǐng) 168 件(jiàn),同比增加 22.63%;NDA 427 件(jiàn),同比增 加 26.71%;ANDA 2241 件(jiàn), 同比增加 60.76%;一(yī)緻性評價申請(qǐng) 990 件(jiàn),同比增加 7.26%;補充申請(qǐng) 3541 件(jiàn),同比增加 20.03%;境外(wài)生(shēng) 産藥品再注冊申請(qǐng) 538 件(jiàn), 同比增加 29.95%。2019 年(nián)至 2023 年(nián)需技(jì)術(shù)審評的(de)各類别注冊申請(qǐng)審結情況詳見(jiàn)圖 18。
2023 年(nián),藥審中心采取多(duō)種措施提高(gāo)審評效率,加快(kuài)藥品審評速度,以臨床價值為(wèi)導向,為(wèi)患者提供更多( duō)的(de)用(yòng)藥選擇。
全年(nián)批準上(shàng)市(shì) 1 類創新藥 40 個(gè)品種(詳見(jiàn)附件(jiàn) 1),其中 9 個(gè)品 種(22.5%)通(tōng)過優先審評審批程序批準上(shàng)市(shì), 13 個(gè)品種(32.5%) 為(wèi)品附條件(jiàn)批準上(shàng)市(shì), 8 個(gè)品種(20%)在臨床研究階段納入了(le)突破 性治療藥物(wù)程序、4 個(gè)新冠治療藥物(wù)(10%)通(tōng)過特别審批程序批準上(shàng)市(shì)。
全年(nián)批準罕見(jiàn)病用(yòng)藥 45 個(gè)品種(未包括化(huà)藥 4 類罕見(jiàn)病用(yòng)藥), 其中 15 個(gè)品種(33.3%)通(tōng)過優先審評審批程序得(de)以加快(kuài)上(shàng)市(shì)(詳見(jiàn)附件(jiàn) 2), 1 個(gè)附條件(jiàn)批準上(shàng)市(shì)。
全年(nián)批準兒(ér)童用(yòng)藥産品 92 個(gè)品種, 包含 72 個(gè)上(shàng)市(shì)許可(kě)申請(qǐng),其 中 26 個(gè)品種(28%)通(tōng)過優先審評審批程序得(de)以加快(kuài)上(shàng)市(shì)(詳見(jλiàn)附件(jiàn) 3);另批準 20 個(gè)品種擴展兒(ér)童适應症, 讓更多(duō)兒(ér)童患者和(hé)千萬家(jiā)庭從(cóng)中受益。
全年(nián)批準 CAR-T 細胞治療産品 3 個(gè), 包括附條件(jiàn)批準伊基奧侖賽注射液、納基奧侖賽注射液上(shàng)市(shì),附條件(jiàn)批準阿基侖賽注射液增加新适應症。
全年(nián)批準境外(wài)已上(shàng)市(shì)、境內(nèi)未上(shàng)市(shì)的(de)原研藥品(化(huà)學藥品♥ 5.1 類、 生(shēng)物(wù)制(zhì)品 3.1 類) 86 個(gè)品種, 其中 62 個(gè)為(wèi)新批準上(shàng)市(shì),包括 1 個(gè)納入臨床急需境外(wài)新藥名單內(nèi)的(de)品種,24 個(gè)為(wèi)新增适應症, 詳見(jiàn)附件(jiàn) 4。
1.中藥注冊申請(qǐng)審結情況
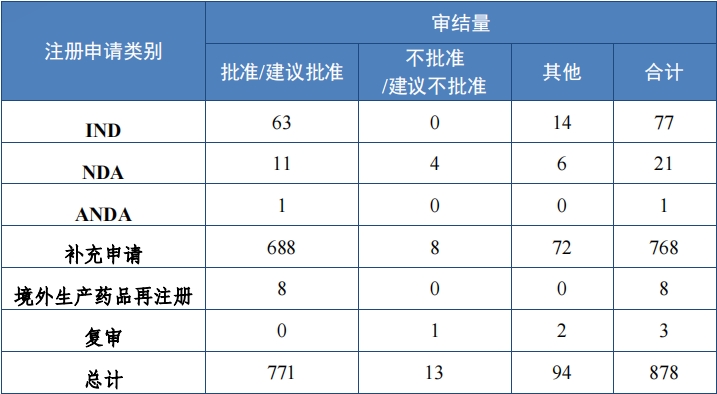
2023 年(nián)審結中藥注冊申請(qǐng) 878 件(jiàn), 同比增加 131.05%。按審評序 列計(jì), IND 77 件(jiàn), 同比增長(cháng) 32.76%;NDA 21 件(jiàn), 同比增加 50.00%;ANDA 1 件(jiàn)。 2023 年(nián)中藥各類别注冊申請(qǐng)審結情況詳見(jiàn)表 5。
批準中藥 IND 63 件(jiàn),同比增長(cháng) 40.00%,包括創新中藥 IND 45件(jiàn)(39 個(gè)品種),同比增長(cháng) 50.00%;改良型中藥 IND 17 件(jiàn)(17 個(gè)品種),同比增長(cháng) 30.77%;同名同方藥 IND 1 件(jiàn)(1 個(gè)品種)。建議(yì)批準 中藥 NDA 11 件(jiàn)(10 個(gè)品種),同比增長(cháng) 37.50%,包括創新中藥 NDA 7 件(jiàn)(6 個(gè)品種);改良型中藥 NDA 1 件(jiàn)(1 個(gè)品種);古代經典名方 中藥複方制(zhì)劑 NDA 3 件(jiàn)(3 個(gè)品種)。建議(yì)批準中藥 ANDA 1 件(jiàn)(1個(gè)品種),屬中藥同名同方藥。
2023 年(nián)各注冊分(fēn)類中藥 IND、NDA 批準/建議(yì)批準情況詳見(jiàn)表 6, 2020 年(nián)至 2023 年(nián)各注冊分(fēn)類中藥 IND 批準情況詳見(jiàn)圖 19 ,2020 年(nián)至 2023 年(nián)各注冊分(fēn)類中藥 NDA 、ANDA 建議(yì)批準情況詳見(jiàn)圖 20。
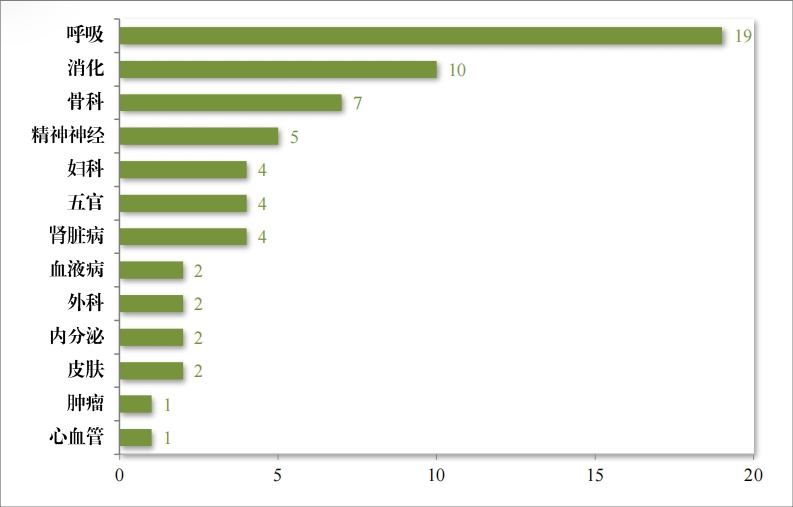
批準的(de) 63 件(jiàn)中藥 IND 中,涉及 13 個(gè)适應症領域,其中呼吸、 消化(huà)藥物(wù)較多(duō),占中藥 IND 批準量的(de) 46.03%。2023 年(nián)批準中藥 IND的(de)适應症領域分(fēn)布情況詳見(jiàn)圖 21。
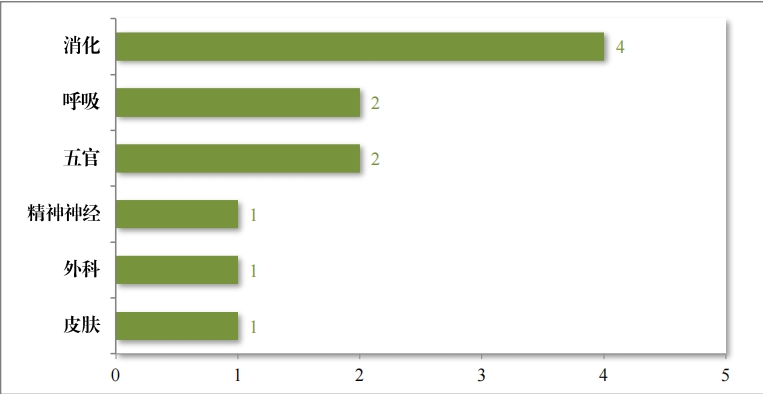
建議(yì)批準的(de)中藥 NDA 11 件(jiàn)中,涉及 6 個(gè)适應症領域,其中消化(huà) 藥物(wù)較多(duō),占中藥 NDA 建議(yì)批準量的(de) 36.36%。2023 年(nián)建議(yì)批準中藥 NDA 的(de)适應症領域分(fēn)布情況詳見(jiàn)圖 22。
2.化(huà)學藥品注冊申請(qǐng)審結情況
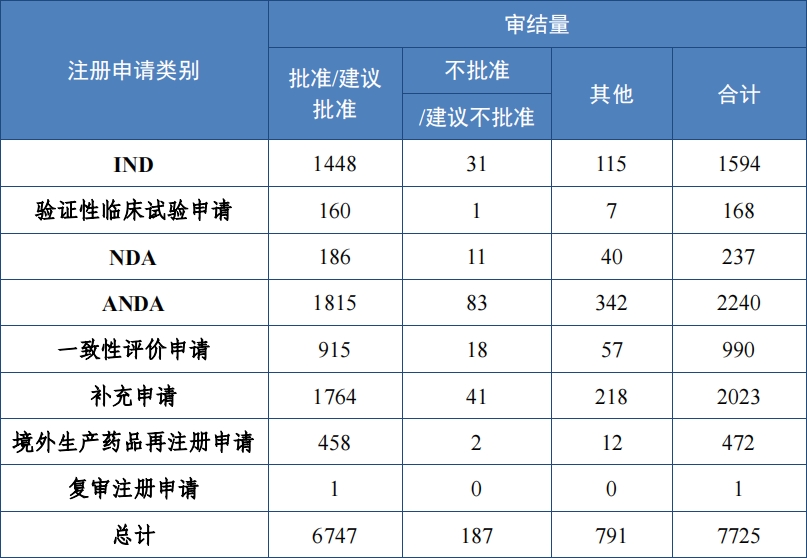
2023 年(nián)審結化(huà)學藥品注冊申請(qǐng) 7725 件(jiàn), 同比增加 24.88%。按審評序列計(jì), 化(huà)學藥品臨床試驗申請(qǐng) 1762 件(jiàn), 同比增加 16.92%;化(huà)學藥品 NDA237 件(jiàn), 同比增加 21.54%;化(huà)學藥品 ANDA 2240 件(jiàn), 同比 增加 60.80%;化(huà)學藥品一(yī)緻性評價申請(qǐng) 990 件(jiàn),同比增長(cháng) 7.26%。2023 年(nián)化(huà)學藥品各類别注冊申請(qǐng)審結情況詳見(jiàn)表 7。
(1)新藥臨床試驗申請(qǐng)和(hé)新藥上(shàng)市(shì)申請(qǐng)
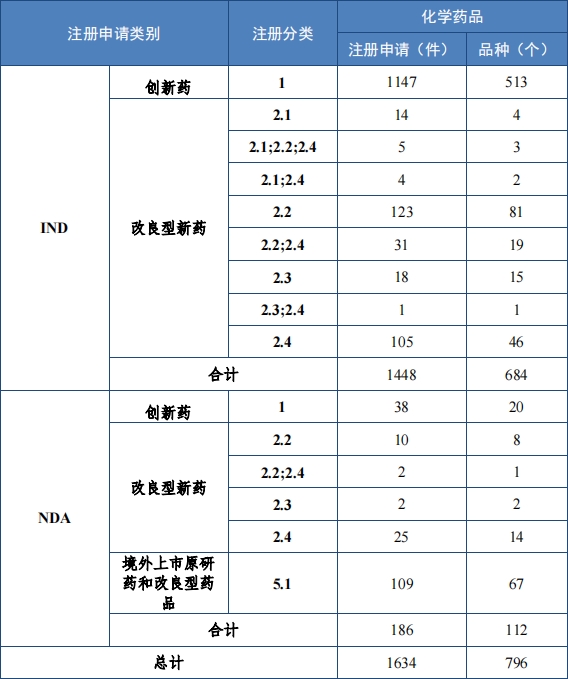
批準化(huà)學藥品 IND 1448 件(jiàn),同比增加 15.92%,包括創新化(huà)學藥 品 IND 1147 件(jiàn)(513 個(gè)品種),同比增加 13.12%;改良型化(huà)學藥品 IND301 件(jiàn)(171 個(gè)品種), 同比增加 27.54%。建議(yì)批準化(huà)學藥品 NDA186 件(jiàn)(109 個(gè)品種),同比增加 21.57%,包括創新化(huà)學藥品 NDA 38 件(jiàn)(20 個(gè)品種),同比增加 123.53%;改良型化(huà)學藥品 NDA 39 件(jiàn) (25 個(gè)品種),同比減少(shǎo) 20.41%;5.1 類化(huà)學藥品 NDA109 件(jiàn)(67 個(gè)品種),同比增加 31.33%。
2023 年(nián)各注冊分(fēn)類化(huà)學藥品 IND、NDA 批準/建議(yì)批準情況詳見(jiàn)表 8 ,2019 年(nián)至 2023 年(nián)各注冊分(fēn)類化(huà)學藥品臨床試驗申請(qǐng)批準情況詳見(jiàn)圖 23 ,2019 年(nián)至 2023 年(nián)各注冊分(fēn)類化(huà)學藥品 NDA 建議(yì)批準情況詳見(jiàn)圖 24。
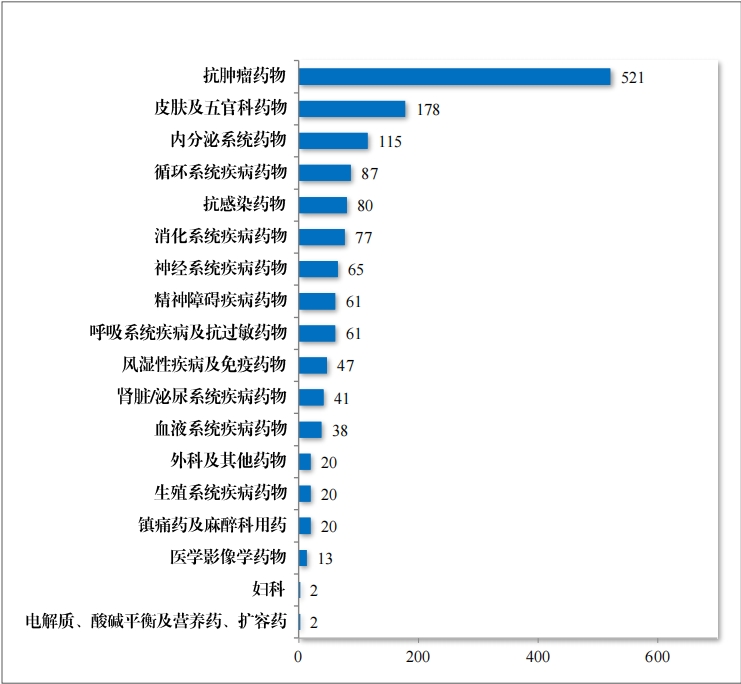
批準的(de)化(huà)學藥品 IND 1448 件(jiàn)中,抗腫瘤藥物(wù)占 35.98%、皮膚及 五官科(kē)藥物(wù)占 12.29%, 內(nèi)分(fēn)泌系統藥物(wù)占 7.94%。2023 年(nián)批準化(huà)學藥品 IND 的(de)适應症領域分(fēn)布情況詳見(jiàn)圖 25。
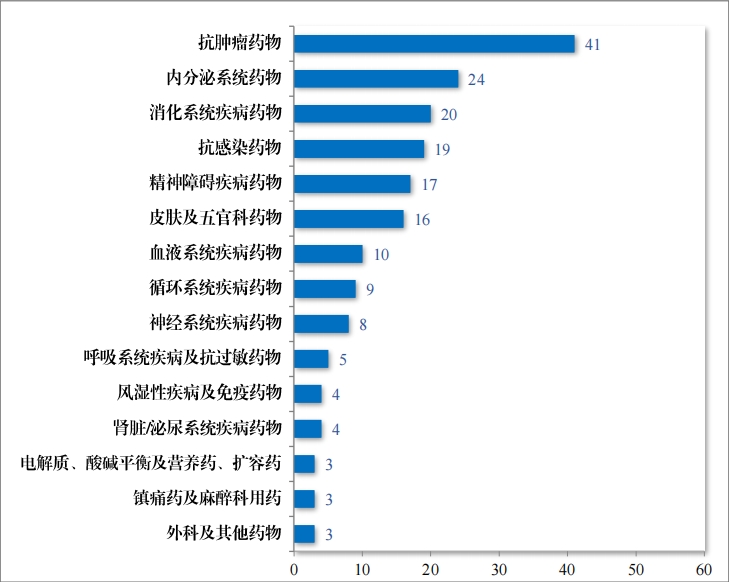
建議(yì)批準的(de)化(huà)學藥品 NDA 186 件(jiàn)中,抗腫瘤藥物(wù)占 22.04%、內(nèi) 分(fēn)泌系統藥物(wù)占 12.90%,消化(huà)系統疾病藥物(wù)占 10.75%。2023 年(nián)建議(yì)批準化(huà)學藥品 NDA 的(de)适應症領域分(fēn)布情況詳見(jiàn)圖 26。
(2)化(huà)學仿制(zhì)藥上(shàng)市(shì)申請(qǐng)
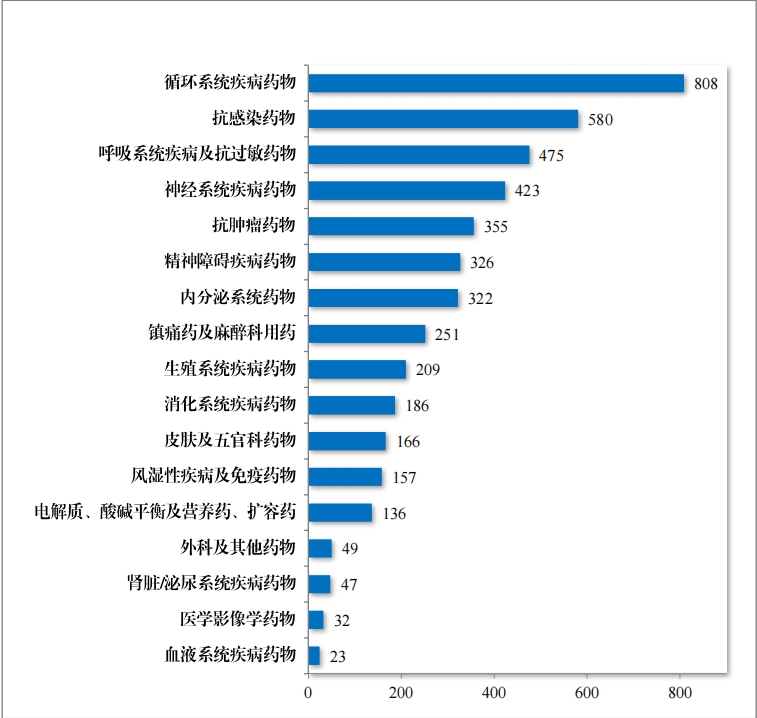
2023 年(nián)建議(yì)批準化(huà)學仿制(zhì)藥上(shàng)市(shì)申請(qǐng) 1815 件(jiàn),其中首仿品種 246個(gè),有(yǒu)效滿足了(le)臨床患者對(duì)高(gāo)質量仿制(zhì)藥的(de)需求。化(h↑uà)學藥品注冊分(fēn)類改革以來(lái),藥審中心按照(zhào)與原研藥品質量和(hé)療 效一(yī)緻性的(de)要(yào)求,累計(j₽ì)建議(yì)批準化(huà)學仿制(zhì)藥 4545 件(jiàn)(864 個(gè)品種),涉及循環、抗感染、呼吸等 17 個(gè)治療領域,具體(tǐ)見(jiàn)圖 27。
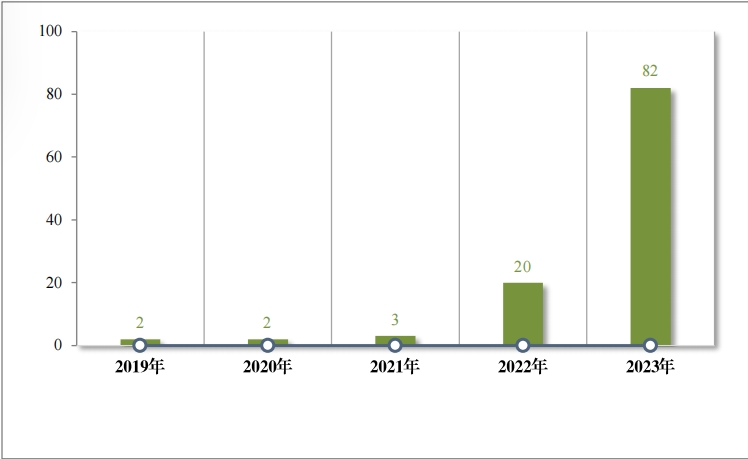
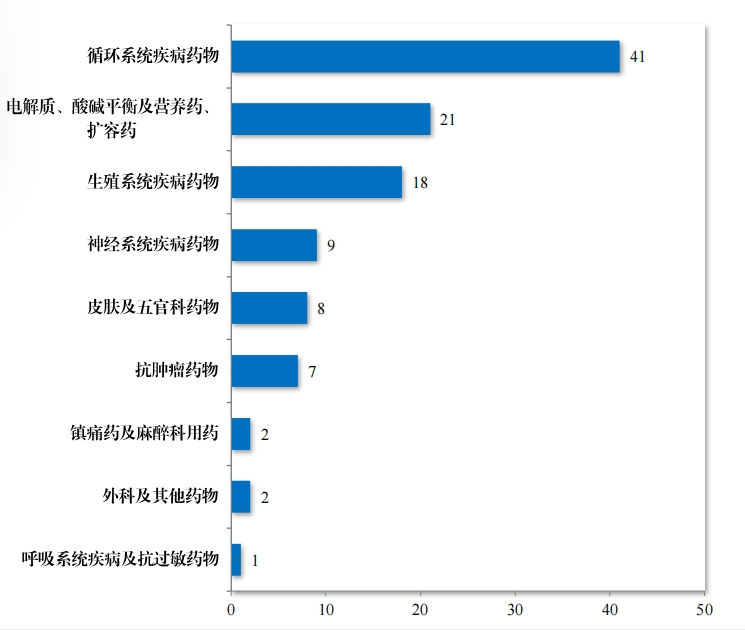
2020 年(nián),國(guó)家(jiā)衛生(shēng)健康委員(yuán)會(huì)、國(guó)家(jiā)發展改革委員(yuán∏)會(huì)等十二部 門(mén)發布了(le)國(guó)家(jiā)短(duǎn)缺藥品清單,側重在應對(duì)解決生(shēng)産™供應端短(duǎn)缺問(wèn)題, 保障藥品供應。為(wèi)落實短(duǎn)缺藥品清單管理(lǐ)制(zhì)度,做(zuβò)好(hǎo)短(duǎn)缺藥品保供穩 價工(gōng)作(zuò),2023 年(nián),藥審中心共建議(yì)批準“ 國(guó)家(jiā)短(duǎn)缺藥品清單” 藥品 82 件(jiàn)(18 個(gè)品種)。近(jìn)五年(nián)累計(jì)批準上(shàng)市(shì)的(de)短(duǎβn)缺藥品共 109 件(jiàn)(25 個(gè)品 種),見(jiàn)圖 28,涉及生(shēng)殖、循環、電(diàn)解質、腫瘤等 9 個(gè)治療領域,具體(tǐ)涉及适應症請(qǐng)見(jiàn)圖 29,有(yǒu)效的(de)保障了(le)短(duǎn)缺藥品的(de)供應。
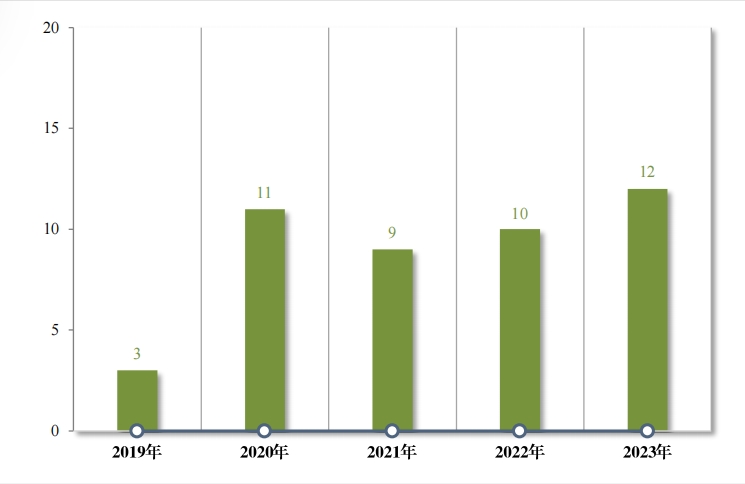
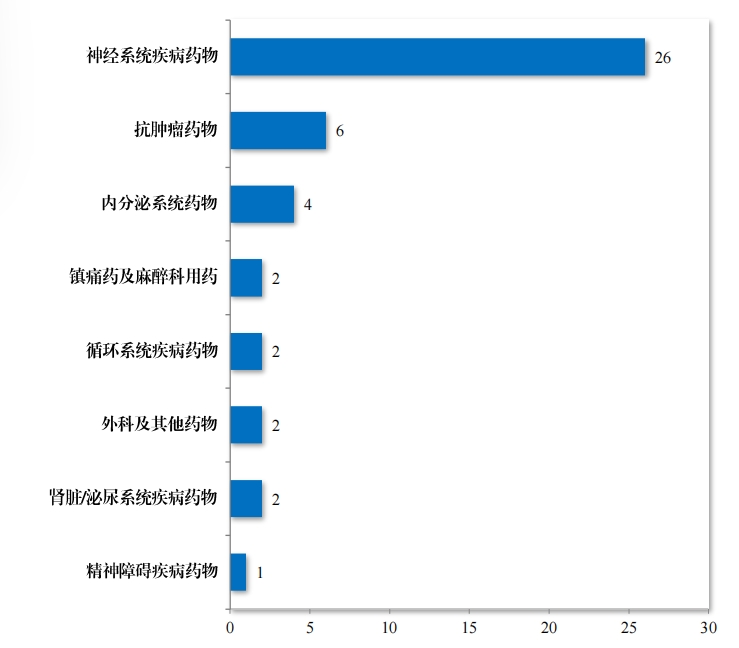
為(wèi)進一(yī)步促進兒(ér)童适宜品種、劑型、規格的(de)研發創制(zhì)和(hé)申報(bào)審評, 滿足兒(ér)科(kē)臨床用(yòng)藥需求, 自(zì) 2016 年(nián),國(guó)家(jiā)衛生(shēng)健康委員(yuán)會(huì)同科(kē)技(jì)部、 工(gōng)業(yè)和(hé)信息化↔(huà)部、國(guó)家(jiā)局醫(yī)保局和(hé)國(guó)家(jiā)藥監局研究制(zhì)訂了(l¥e)四批鼓勵研 發申報(bào)兒(ér)童藥品清單,共有(yǒu) 136 個(gè)品種,包括口服溶液劑、口服混懸 劑、顆粒劑等适宜兒(ér)童給藥劑型。 2023 年(nián), 藥審中心建議(yì)批準屬于 鼓勵研發申報(bào)兒(ér)童藥品清單的(de)兒(ér)童用(yòng)仿制(zhì)藥 12 件(jiàn)(8 個(gè)品種)。2019 年(nián)以來(lái)累計(jì)建議(yì)批準屬于鼓勵研發申報(bào)兒(ér)童藥品清單的(de)兒(ér)童用(yòng)仿制(zhì) 藥 45 件(jiàn)(18 個(gè)品種),見(jiàn)圖 30,涉及神經、抗腫瘤、內(nèi)分(fēn)泌等 8 個(gè)治療領域,具體(tǐ)涉及适應症情況請(qǐng)見(jiàn)圖 31。
(3)化(huà)學仿制(zhì)藥質量和(hé)療效一(yī)緻性評價工(gōng)作(zuò)
2023 年(nián),藥審中心持續推進化(huà)學仿制(zhì)藥質量和(hé)療效一(yī)緻性評價 工(gōng)作(zuò),為(wèi)患者提供高(gāo)質量仿制(zhì)藥π,共發布參比制(zhì)劑目錄 12 批,涉及 804 個(gè)品規(497 個(gè)品種)。截至 2023 年(nián) 12 月(yuè) 31 日(rì),藥審中心共收 到(dào)參比制(zhì)劑遴選申請(qǐng)信息 7955 條(3127 個(gè)品種)、自(zì)證信息 380 條 (286 個(gè)品種),累計(jì)發布 74 批參比制(zhì)劑目錄, 共 6714 個(gè)品規(2516個(gè)品種)。
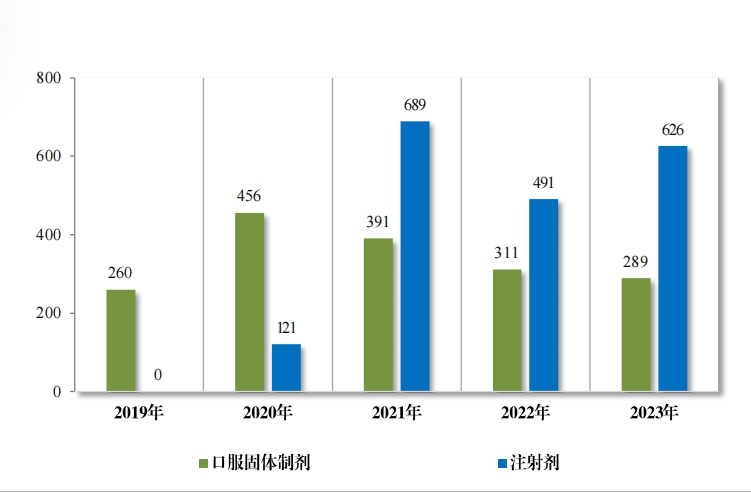
2023 年(nián)審評通(tōng)過一(yī)緻性評價 915 件(jiàn)(326 個(gè)品種),其中,口服固體(tǐ)制(zhì)劑通(tōng)過 289 件(jiàn)(163 個(gè)品種);注射劑通(tōng)過 626 件(jiàn)(163 個(gè)品種)。 自(zì)化(huà)學仿制(zhì)藥質量和(hé)療效一(yī)緻性評價工(gōng)作(zuò)開(kāiε)展以來(lái),累計(jì)通(tōng)過一(yī)緻性 評價申請(qǐng)共 3797 件(jiàn)(共計(jì) 666 個(gè)品種),其中, 口服固體(tǐ)制(zhì)劑通(tōng)過 1836 件(jiàn)(計(jì) 417 個(gè)品種);注射劑通(tōng)過 1961 件(jiàn)(計(jì) 249 個(gè)品種)。2019年(nián)至 2023 年(nián)一(yī)緻性評價申請(qǐng)批準情況詳見(jiàn)圖 32。
3.生(shēng)物(wù)制(zhì)品注冊申請(qǐng)審結情況
2023 年(nián),審結生(shēng)物(wù)制(zhì)品注冊申請(qǐng) 2030 件(jiàn),同比增加 7.41%。其 中,預防用(yòng)生(shēng)物(wù)制(zhì)品 179 件(jiàn)和(hé)治療用(yòng)生(shēng)物(wù)制(zhì)品 1839 件(jiàn), 體(tǐ)外(wài)診斷試劑 12 件(jiàn)。
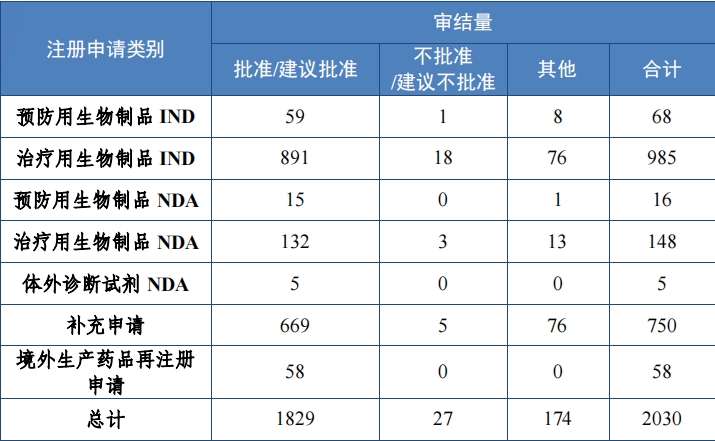
按審評序列計(jì), IND 1053 件(jiàn), 同比增加 20.76%;NDA 169 件(jiàn), 同比增加 32.03%;補充申請(qǐng) 750 件(jiàn);境外(wài)生(shēng)産藥品再注冊申請(qǐng) 58 件(jiàn)。2023 年(nián)生(shēng)物(wù)制(zhì)品各類别注冊申請(qǐng)審結情況詳見(jiàn)表 9。
(1)預防用(yòng)生(shēng)物(wù)制(zhì)品
批準預防用(yòng)生(shēng)物(wù)制(zhì)品 IND 59 件(jiàn),包括創新預防用(yòng)生(shēng)物(wù)制(zhì)品 IND 31 件(jiàn)(27 個(gè)品種),同比增加 72.22%;改良型預防用(yòng)生(shēng)物(wù)制(zhì)品 IND 13 件(jiàn)(10 個(gè)品種), 同比增加 8.33%;境內(nèi)或境外(wài)已上(shàng)市(shì)預防用(yòng)生(shēng)物(wù)制(zhì)品 IND 15 件(jiàn)(9 個(gè)品種),同比增加 50.00%。
建議(yì)批準預防用(yòng)生(shēng)物(wù)制(zhì)品 NDA 15 件(jiàn), 包括創新預防用(yòng)生(shēng)物(wù)制(zhì)品 NDA2 件(jiàn)(2 個(gè)品種);境內(nèi)或境外(wài)已上(shàng)市(shì)預防用(yòng)生(shēng)物(wù)制(zhì)品 NDA 11 件(jiàn) (9 個(gè)品種),另有(yǒu) 2 件(jiàn)(2 個(gè)品種)為(wèi)原《藥品注冊管理(lǐ)辦法》規定的(de)已有(yǒu)國(guó)家(jiā)藥品标準的(de≤)疫苗。
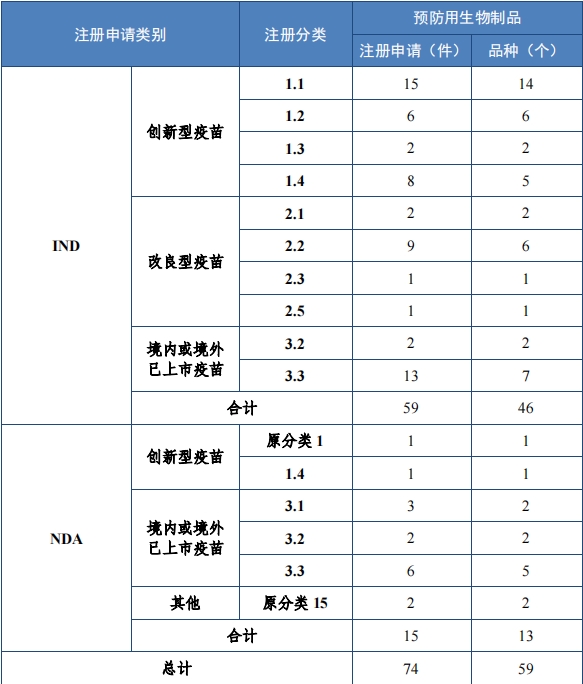
2023 年(nián)各注冊分(fēn)類預防用(yòng)生(shēng)物(wù)制(zhì)品 IND、NDA 批準/建議(yì)批準情 況詳見(jiàn)表 10 ,2020 年(nián)至 2023 年(nián)各注冊分(fēn)類預防用(yòng)生(shēng)物(wù)制(zhì)品 IND 批 準情況詳見(jiàn)圖 33,2020 年(nián)至 2023 年(nián)各注冊分(fēn)類預防用(yòng)生(shēng)物(wù)制(zhì)品 NDA建議(yì)批準情況詳見(jiàn)圖 34。
(2)治療用(yòng)生(shēng)物(wù)制(zhì)品
批準治療用(yòng)生(shēng)物(wù)制(zhì)品 IND 891 件(jiàn),包括創新治療用(yòng)生(shēng)物(wù)制(zhì)品 IND 695 件(jiàn)(510 個(gè)品種),同比增加 25.68%;改良型治療用(yòng)生(shēng)物(wù)制(zhì)品 IND 134 件(jiàn)(69 個(gè)品種),同比增加 20.72%;境內(nèi)或境外(wài)已上(shàng)市(shì)治療用(yòng)生(shēng)物(wù)制(zhì)品 IND 62 件(jiàn)(37 個(gè)品種),與去(qù)年(nián)持平。
建議(yì)批準治療用(yòng)生(shēng)物(wù)制(zhì)品 NDA 132 件(jiàn),包括創新治療用(yòng)生(shēng)物(wù)制(zhì) 品 NDA 19 件(jiàn)(15 個(gè)品種),同比增加 111.11%;改良型治療用(yòng)生(shēng)物(wù)制(zhì)品NDA 19 件(jiàn)(13 個(gè)品種);境內(nèi)或境外(wài)已上(shàng)市(shì)治療用(yòng)生(shēng)物(wù)∑制(zhì)品NDA92 件(jiàn)(52 個(gè)品種),同比增加 84.00%,其中包括生(shēng)物(wù)類似藥(3.3 類)24 件(jiàn)(15 個(gè)品種)。(原 15 類 1 件(jiàn), 7 類 1 件(jiàn))2023 年(nián)各注冊分(fēn)類治療用(yòng)生(shēng)物(wù)制(zhì)品 IND、NDA 批準/建議(yì)批準情 況詳見(jiàn)表 11,2020 年(nián)至 2023 年(nián)各注冊分(fēn)類治療用(yòng)生(shēng)物(wù)制(zhì)品 IND 批 準情況詳見(jiàn)圖 35,2020 年(nián)至 2023 年(nián)各注冊分(fēn)類治療用(yòng)生(shēng)物(wù)制(zhì)品 NDA建議(yì)批準情況詳見(jiàn)圖 36。
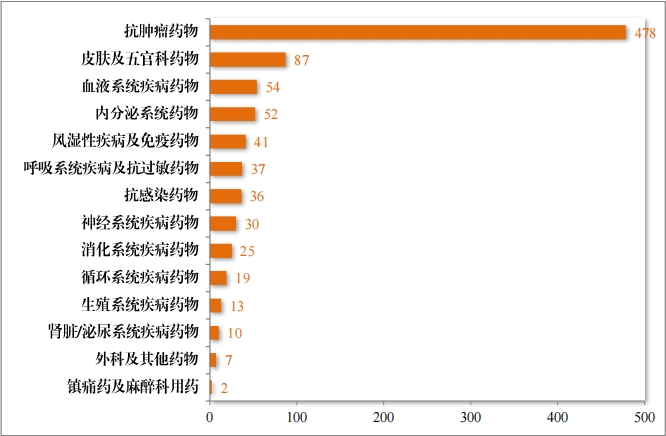
批準的(de)治療用(yòng)生(shēng)物(wù)制(zhì)品 IND891 件(jiàn)中,抗腫瘤藥物(wù)占比 53.65%, 皮膚及五官科(kē)藥物(wù)占比 9.76%,血液系統疾病藥物(wù)占比 6.06%。2023年(nián)批準治療用(yòng)生(shēng)物(wù)制(zhì)品 IND 的(de)适應症領域分(fēn)布情況詳見(jiàn)圖 37。
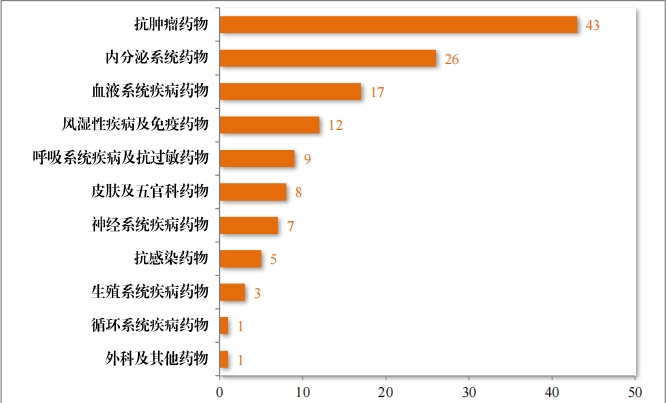
建議(yì)批準的(de)治療用(yòng)生(shēng)物(wù)制(zhì)品 NDA 132 件(jiàn)中,抗腫瘤藥物(wù)占比 32.58%,內(nèi)分(fēn)泌系統藥物(wù)占比 19.70%,血液系統疾病藥物(wù) 12.88%。 2023 年(nián)建議(yì)批準治療用(yòng)生(shēng)物(wù)制(zhì)品NDA 的(de)适應症領域分(fēn)布情況詳見(jiàn)圖38。
(三)直接行(xíng)政審批類注冊申請(qǐng)審結情況
2023 年(nián)審結直接行(xíng)政審批類注冊申請(qǐng)3881 件(jiàn),同比增加33.74%; 其中無需技(jì)術(shù)審評的(de)補充申請(qǐng) 3502 件(jiàn),同比增加 37.60%;臨時(shí)進口 注冊申請(qǐng) 379 件(jiàn),同比增加 6.16%。2019 年(nián)至 2023 年(nián)直接審批的(de)各類别注冊申請(qǐng)審結情況詳見(jiàn)圖 39。
第三章(zhāng) 加快(kuài)新藥好(hǎo)藥上(shàng)市(shì),滿足臨床患者需求
2023 年(nián)度, 藥審中心通(tōng)過藥品加快(kuài)上(shàng)市(shì)注冊程序,加強與申請(qǐng) 人(r¥én)的(de)溝通(tōng)互動, 縮短(duǎn)藥物(wù)研發與技(jì)術(shù)審評時(shí)間(jiān),∞為(wèi)患者提供更多(duō)治療 嚴重危及生(shēng)命疾病、應對(duì)公共衛生(shēng)事(shì)件(jiàn)的(de)安全、有(yǒu∑)效、質量可(kě)控的(de)臨床用(yòng)藥。
(一(yī))突破性治療藥物(wù)程序
藥物(wù)臨床試驗期間(jiān),用(yòng)于防治嚴重危及生(shēng)命或者嚴重影(yǐng)響生(shēng)存質← 量的(de)疾病且尚無有(yǒu)效防治手段或者與現(xiàn)有(yǒu)治療手段相(xiàng)比有(yǒu)足夠證據 表明(míng)具有(yǒu)明(míng)顯臨床優勢的(de)創新藥或者改良型新藥等, 申請(qǐng)人(rén)可(kě)以在Ⅰ、 Ⅱ期臨床試驗階段,通(tōng)常不(bù)晚于Ⅲ期臨床試驗開(kāi)展前申請(qǐng)适用(yòng)突破性 治療藥物(wù)程序。對(duì)于适用(yòng)突破性©治療程序的(de)藥物(wù),其臨床試驗期間(jiān)溝 通(tōng)交流包括首次溝通(tōng)交流、因重大(dà)安全性問(wèn)題/重大(dà)技(jì)術(shù)問(wèn)題而召開(kāi) 的(de)會(huì)議(yì)、藥物(wù)臨床試驗關鍵階段會(huì)議(yì)以及一(yī)般性技(jì)≠術(shù)問(wèn)題咨詢等, 藥審中心優先配置資源進行(xíng)溝通(tōng)交流, 加強指導并促進藥物(wù)研發。
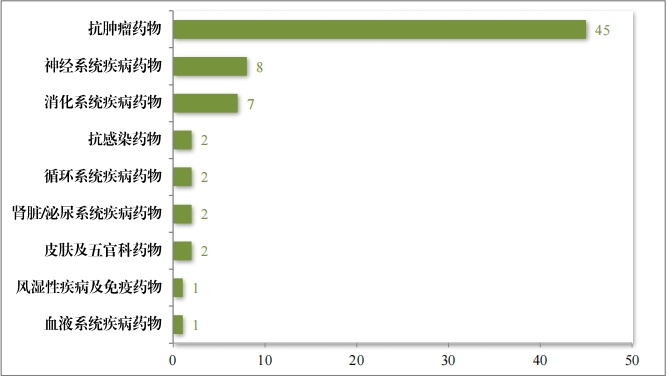
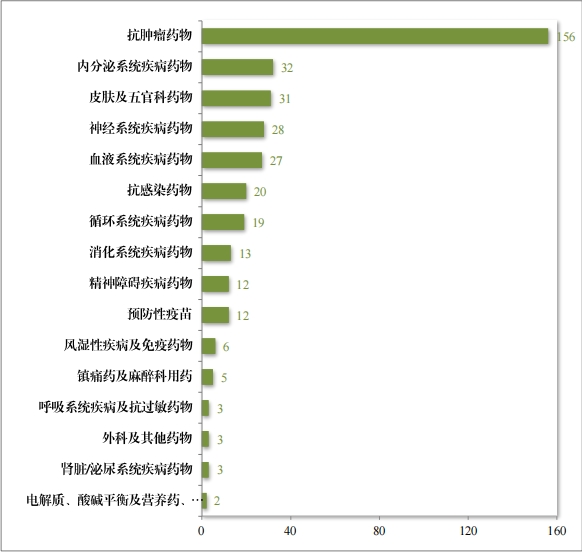
2023 年(nián)度, 共收到(dào)突破性治療藥物(wù)程序申請(qǐng) 286 件(jiàn),同意納入 突破性治療藥物(wù)程序 70 件(jiàn)(見(jiàn)附件(jiàn) 6),占申請(qǐng)數(shù)量的(de) 24.5%,較 2022 年(nián)增加 43%。排名前三的(de)分(fēn)别為(wèi)抗腫瘤藥物(wù)、神經系統疾病藥物(wù)及消化(huà)系統疾病藥物(★wù),具體(tǐ)适應症分(fēn)布情況請(qǐng)見(jiàn)圖 41。
(二)附條件(jiàn)批準程序
藥物(wù)臨床試驗期間(jiān),治療嚴重危及生(shēng)命且尚無有(yǒu)效治療手段的(de)疾病以及公共衛生(shēng)方面急需的(de)藥σ品,藥物(wù)臨床試驗已有(yǒu)數(shù)據顯示療效并能(néng)預測其臨床價值的(de),以及應對(duì)重大(dà)突發公共衛生(shēng)事(shì)件(jiàn)急需的(deα)疫苗或 者國(guó)家(jiā)衛生(shēng)健康委員(yuán)會(huì)認定急需的(de)其他(t§ā)疫苗, 經評估獲益大(dà)于風(fēng)險的(de), 可(kě)基于替代終點、中間(jiān)臨床終點或早期臨床試驗數(shù)據而附條件(jiàn)批準上(shàng) 市(shì)。附條件(jiàn)批準上(shàng)市(shì)的(de)目的(de)是(shì)縮短(duǎn)藥物(wù)臨床試驗的(de)研發時(shí)間(jiān),δ 使其盡早應用(yòng)于無法繼續等待的(de)危重疾病或公共衛生(shēng)方面急需的(de)患•者。
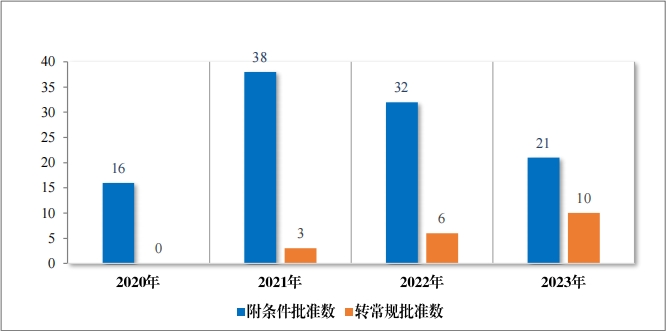
2023 年(nián)共有(yǒu) 21 個(gè)藥品附條件(jiàn)批準上(shàng)市(shì),其中 16 個(gè)藥品為(wèi)首次 批準上(shàng)市(shì),5 個(gè)藥品為(wèi)新增适應症(見(jiàn)附件(jiàn) 7)。同時(shí), 在 2023 年(nián), 共有(yǒu) 10 個(gè)附條件(jiàn)批準上(shàng)市(shì)藥品完成了(le)上(shàng)市(shì)後研究,轉為(wèi)了(le)常規批準。♠ 自(zì) 2020 年(nián)《藥品注冊管理(lǐ)辦法》(總局第 27 号令)實施以來(lái), 共有(yǒu) 95 個(gè)藥品附條件(jiàn)批準上(shàng)市(shì),涉及 107 個(gè)适應症,包括抗腫瘤、抗新 冠疫苗及治療藥物(wù)、血液系統疾病藥物(wù)等, 其中抗腫瘤藥占>比最多(duō), 為(wèi) 79%,共有(yǒu) 19 個(gè)附條件(jiàn)批準上(shàng)市(shì)藥品完成了(le)上(shàng)市(shì)後研究, 轉為(wèi)了(le)常規♦批準,具體(tǐ)請(qǐng)見(jiàn)圖 42、圖 43。
(三)優先審評審批程序
藥品上(shàng)市(shì)許可(kě)申請(qǐng)時(shí), 對(duì)于以下(xià)具有(yǒu)明(míng)顯臨床價值的(de)藥品, 可(kě)以 申請(qǐng)适用(yòng)優先審評審批程序:(一(yī))臨床急需的(de)短(duǎn)缺藥品、防治重大(dà) 傳染病和(hé)罕見(jiàn)病等疾病的(de)創新藥和(hé)改良型新藥;(二) 符合兒(ér)童生(shēng)理(lǐ) 特征的(de)兒(ér)童用(yòng)藥品新品種、劑型和(hé)規格;(三) 疾病預防、控制(zhì)急需 的(de)疫苗和(hé)創新疫苗;(四) 納入突破性治療藥物(wù)程序的(de)藥品;(五) 符 合附條件(jiàn)批準的(de)藥品;(六) 國(guó)家(jiā)藥品監督管理(lǐ)局規定其他(tā)優先審評 審批的(de)情形。獲得(de)适用(yòng)優先審評審批程序的(de)上(shàng)市(shì)注冊申請(qǐng)的(de)審評時(sh&í)限 由常規程序的(de) 200 日(rì)縮短(duǎn)為(wèi) 130 日(rì),其中臨床急需的(de)境外(wài)已上(shàng)市(shì)境內(nèi)未上(shàng)市(shì)的(de)罕見(jiàn)病•藥品審評時(shí)限為(wèi) 70 日(rì)。
2023 年(nián)度共納入優先審評審批注冊申請(qǐng) 108 件(jiàn)(80 個(gè)品種),同 比增加 56.9%,具體(tǐ)納入情況見(jiàn)圖 44。2023 年(nián)有(yǒu) 85 件(jiàn)(59 個(gè)品種)注冊申請(qǐng)按照(zhào)優先審評審批程序批準上(shàng)市(shì)。
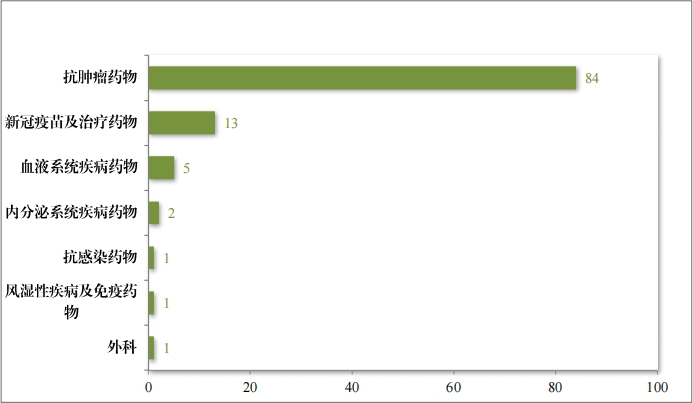
自(zì) 2020 年(nián)《藥品注冊管理(lǐ)辦法》(總局第 28 号令)實施以來(lái),共有(yǒu) 372 個(gè)藥品注冊申請(qǐng)納入優先審評審批程序,涉及的(de)抗腫瘤藥物(wù)、 內(nèi)分(fēn)泌系統藥物(wù)、皮膚及五官科(kē)藥物(wù)等,其中抗腫瘤藥占比最多(du♥ō),為(wèi)42%,具體(tǐ)請(qǐng)見(jiàn)圖 45。
第四章(zhāng) 藥品研發與審評溝通(tōng)交流情況
溝通(tōng)交流是(shì)在藥物(wù)研發與注冊申請(qǐng)過程中, 申請(qǐng)人(rén)與藥審中心審 評團隊之間(jiān)針對(duì)所研發産品進行(xíng)的(de)不(bù)同形式的(de)討(tǎo)論,是(shì)藥審中心☆服務于申請(qǐng)人(rén)的(de)重要(yào)舉措之一(yī)。
(一(yī))溝通(tōng)交流會(huì)議(yì)申請(qǐng)與辦理(lǐ)情況
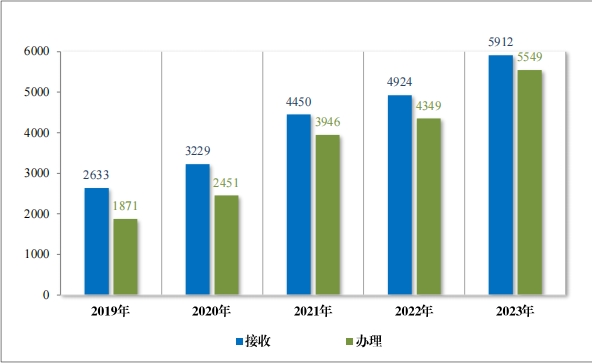
2023 年(nián), 藥審中心共接收溝通(tōng)交流會(huì)議(yì)申請(qǐng) 5912 件(jiàn), 同比增加 20.06%,為(wèi) 1607 家(jiā)企業(yè)的(de) 3710 個(gè)品種(按照(zhào)申請(qǐng)人(rén)提交溝通(tōng)交流申 請(qǐng)時(shí)的(de)≥藥品名稱計(jì),下(xià)同)提供了(le)溝通(tōng)交流服務,辦理(lǐ)溝通(tōng)交流會(huì)議(yì) 申請(qǐn g) 5549 件(jiàn), 同比增加 27.59%,其中召開(kāi)面對(duì)面會(huì)議(yì)/電(diàn)話(huà)會(huì)議(yì) 612 個(gè),同比增加 24.29%。自(zì) 2017 年(nián)建立溝通(tōng)交流會(huì)議(yì)制(zhì)度以來(lái),為(wèi) 3180 家(jiā)企業(yè)的(de) 11680 個(gè)品種在研發的(de)關鍵階段就(jiù)重大(dà)問(wèn)題進行(xíng)了(le)溝通(tōng)指 導, 充分(fēn)服務申請(qǐng)人(rén↑), 2019 年(nián)至 2023 年(nián)接收及辦理(lǐ)溝通(tōng)交流會(huì)議(yì)申請(qǐng)情況詳見(jiàn)圖 46。
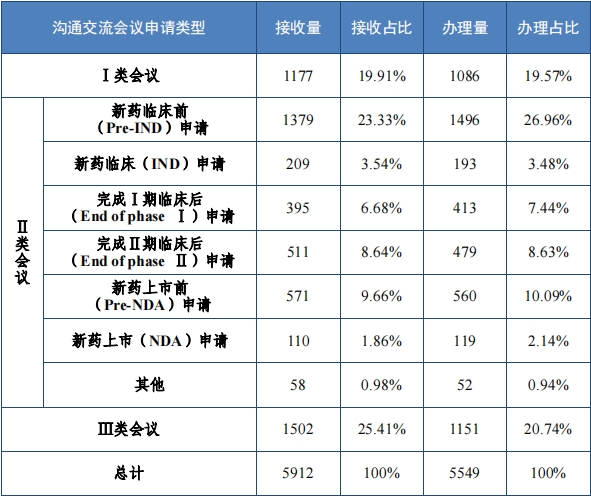
2023 年(nián),藥審中心辦理(lǐ)溝通(tōng)交流會(huì)議(yì)申請(qǐng) 5549 件(jiàn), 召開(kāi)面對(duì)面 會(huì)議(yì)或電(diàn)話(huà)會(huì)議(yì) 612 次, 在藥物(wù)研發關鍵階段辦理(lǐ)的(de)Ⅱ類會(huì)議(yì)占比 54.69%,其中新藥臨床試驗申請(qǐng)前(Pre-IND)申請(qǐng)占比 23.33%,新 藥上(shàng)市(shì)許可(kě)申請(qǐng)前(Pre-NDA)申請(qǐng)占比 9.66% 。2023 年(nián)溝通(tōng)交流會(huì)議(yì)申請(qǐng)接收及辦理(lǐ)情況詳見(jiàn)表 12。
(二) 一(yī)般性技(jì)術(shù)問(wèn)題咨詢情況
2023 年(nián)接收一(yī)般性技(jì)術(shù)問(wèn)題咨詢 16694 個(gè), 為(wèi) 3831 家(jiā)企業(yè)答(dá)疑 一(yī)般性技(jì)術(shù)問(wèn)題咨詢 18173 個(gè),經梳理(lǐ)總結, 發布常見(jiàn)一(yī)般性技(jì)術(shù)問(wèn) 題及解答(dá)共 6 批 63 個(gè)。自(zì) 2017 年(nián)開(kāi)展一(yī)般性技(jì)術(shù)問(wèn)題咨詢以來(lái), 為(wèi) 7033 家(jiā)企業(yè)在研發過程和(hé)審評過程中就(jiù) 108003 個(gè)一(yī)般性技(jì)術(shù)問(wèn)題進 行(xíng)了(le)答(dá)疑,總結發布 22 批 214 個(gè)共性問(wèn)題4,同一(yī)企業(yè)累計(jì)提問(wèn)數(shù)量分(fēn)布情況詳見(jiàn)表 13,2019 年(nián)至 2023 年(nián)接收及辦理(lǐ)一(yī)般性技(jì)術(shù)問(wèn)題咨詢量詳見(jiàn)圖 47。

第五章(zhāng) 藥品研發指導原則方面工(gōng)作(zuò)
(一(yī))持續完善審評标準體(tǐ)系建設
2023 年(nián)藥審中心制(zhì)修訂指導原則 74 個(gè),新發布指導原則 60 個(gè)(詳見(jiàn)附件(jiàn) 8),累計(jì)發布藥品技(jì)術(shù)指導原則達 482 。
1.聚焦國(guó)際前沿技(jì)術(shù)領域, 推動指導原則體(tǐ)系與國(guó)際先進技(jì)術(®shù)标準深度融合
為(wèi)推動 ICH Q13 指導原則在我國(guó)落地(dì)實施,發布了(le)國(guó)內(nèi)首個(gè)《化(huà) 藥口服固體(tǐ)制(z hì)劑連續制(zhì)造技(jì)術(shù)指導原則(試行(xíng))》。持續完善我國(guó)真實 世≈界證據指導原則體(tǐ)系,繼真實世界證據、真實世界數(shù)據的(de)評價等技(jì) 術(shù)要(yào)求,今年(nián)發布實施了(le)《藥 物(wù)真實世界研究設計(jì)與方案框架指導原 則(試行(xíng))》真實世界證據支持藥物(wù)注冊申請(qǐng)的(de)溝通(tōng)交流指導原則試行(xíng))2 項技(jì)術(shù)指導原則。
加快(kuài)完善放(fàng)射性治療藥物(wù)評價體(tǐ)系, 制(zhì)定發布了(le)《放(fàng)射性體(tǐ)內(nèi)治療藥物(wù)臨床評價技(j£ì)術(shù)指導原則》《放(fàng)射性治療藥物(wù)非臨床研究技(jì)術(shù)指導原則(征求意見(jiàn)稿)》《>放(fàng)射性标記人(rén)體(tǐ)物(wù)質平衡研究技(jì)術(shù)指導原則(征求意見(jiàn)稿)》<《放(fàng)射性化(huà)學仿制(zhì)藥藥學研究技(jì)術(shù)指導原則(征求意見(jiàn)稿)》等 4 項技(jì)術(shù)指導原則, 推動相(xiàng)關産品加快(kuài)研發上(shàng)市(shì)。
加快(kuài)完善細胞和(hé)基因治療技(jì)術(shù)評價體(tǐ)系,制(zhì)定發布了(le)腫瘤主動免 疫治療産品、人(rén)源性幹細胞、溶瘤病毒、基因治療治療血友(yǒu)病等 5 項技(jì)術(shù)指導原則。
2.凝聚國(guó)際共識及監管實踐,持續完善創新藥物(wù)研發技(jì)術(shù)評價體(tǐ)系,有(yǒu)效縮短(duǎn)新藥研®發上(shàng)市(shì)進程
首次将“ 以患者為(wèi)中心” 和(hé)基于“ 動物(wù)法則(Animal Rule)” 藥物(wù)注 冊理(lǐ)念納入指導原則, 标志(zhì)著(zhe)我國(guó)藥物(wù)研發策略進入了(le)新階段。Ω持續 完善創新藥物(wù)研發共性技(jì)術(shù)要(yào)求,發布實施了(le)新藥 III 期臨床試驗前 藥學溝通(tōng)交流、化(huà)藥複方藥物(wù)臨床試驗設計(jì)、新藥獲益-風(fēng)險評估、 臨床試驗期間(jiān)安全性信息評價、藥物(wù)性肝損傷、單臂試驗臨床應用(yòng)等7 項技(jì)術(shù)指導原則。
3.探索和(hé)豐富“ 三結合” 注冊審評證據體(tǐ)系,推動符合中醫(yī)藥特點的(de)技(jì)術(shù)标準體(tǐ)系建設
圍繞構建和(hé)完善“ 三結合” 審評證據體(tǐ)系的(de)工(gōng)作(zuò)任務,針對(duì)中藥研 發瓶頸和(hé)熱(rè)點、難點問(wèn)題, 以問(wèn)題為(wèi)導∏向, 不(bù)斷創新工(gōng)作(zuò)方法,依托 中藥監管科(kē)學研究,廣泛開(kāi)展學術(shù)交流,充分(fēn)發揮外(wài)部專家(jiā)的(de)作(zuò)用(☆yòng), 結合審評案例解剖麻雀,總結特點和(hé)規律, 研究形成技(jì)術(shù)标準。2023 年(nián), 發布《基于人(rén)用(yòng)經驗的(de)中藥複方制(zhì)劑新藥藥學研究技(j÷ì)術(shù)指導原則 (試行(xíng))》等 5 項指導原則,同時(shí),聚焦具有(yǒu)中醫(yī)藥治療臨床優勢和(hé) 特點的(de)适應症,起草(cǎo)制(zhìβ)定了(le)糖尿病視(shì)網膜病變、緊張型頭痛、小(xiǎo)兒(ér)便 秘等适應症臨床研究技(jì)術(shù)指導原∑則,加快(kuài)符合中藥特點的(de)療效評價審評标準體(tǐ)系建設。
4.加大(dà)力度解決公衆及特殊群體(tǐ)的(de)用(yòng)藥需求問(wèn)題,提高(gāo)常見(j≈iàn)疾病藥物(wù)研發評價體(tǐ)系覆蓋率
加快(kuài)兒(ér)童用(yòng)藥研發進程,制(zhì)定發布了(le)《生(shēng)理(lǐ)藥代動力學模型在兒(ér)科(kē)↓人(rén)群藥物(wù)研發中應用(yòng)的(de)技(jì)術(shù)指導原則》《成人(rén)用(yòng)藥數(shù↑)據外(wài)推至兒(ér)科(kē)人(rén)群的(de)定量方法學指導原則(試行(xíng))》;為(wè™i)解決特殊群裡(lǐ)用(yòng)藥吞咽困難, 制(zhì)定發布了(le)《咀嚼片(化(huà)學藥品)質量屬性研究技(jì)術(shù)指導原則(試行(xíng))》; 為(wèi)加強說(shuō)明(míng)書(shū)和(hé)标簽規範管理(lǐ),制(zhì)δ定發布了(le)《化(huà)學藥品說(shuō)明(míng)書(shū)及标簽藥學相(xiàng)關信息撰寫指導原則(試行(xíng))》等 4 項技(jì)術(shù)指導原則。
首次推出《人(rén)乳頭瘤病毒疫苗臨床試驗技(jì)術(shù)指導原則(試行(xíng))》, 制(zhì)定發布了(le)首個(gè)《罕見(jiàn)疾病藥物(wù)開(kāi)發中疾病自(zì)然史》;在抗腫瘤藥物(wù) 領域制(zhì)定發布了(le)兒(ér)童抗腫瘤、晚期前列腺癌、卵巢癌 3 項技(jì)術(shù)指導原 則; 在血液系統疾病領域制(zhì)定發布了(le)慢(màn)性淋巴細胞白(bái)血病、急性髓系 白(bái)血病÷ 2 項技(jì)術(shù)指導原則; 在內(nèi)分(fēn)泌系統、抗感染及抗病毒藥物(wù)、消 化(huà)系統疾病等領域制(zhì)定發布了(le)原發性膽汁性膽管炎、成人(rén) 2 型糖尿病、慢(màn)性乙型肝炎病毒感染、非阿片類術(shù)後鎮痛藥物(wù)等 6 項技(jì)術(shù)指導原則。
5.總結仿制(zhì)藥申報(bào)共性問(wèn)題,推動仿制(zhì)藥高(gāo)質量發展
制(zhì)定了(le)國(guó)內(nèi)外(wài)首個(gè)《化(huà)學藥品仿制(zhì)藥溶液型滴眼劑藥學研究技(jì)術(shù) 指導原則》,針對(duì)産品安全性和(hé)質量可(kě)控性關鍵指标,制(zhì)定發布了(le)微(wēi) 生(shēng)物(wù)限度、化(huà)學合成多(duō)肽、阿片類口服固體(tǐ)仿制(zhì)藥 防濫用(yòng)共 3 項技(jì)術(shù)指導原則。
(二) ICH 指南(nán)文(wén)件(jiàn)的(de)轉化(huà)實施
一(yī)是(shì)加快(kuài)與國(guó)際藥品注冊技(jì)術(shù)要(yào)求接軌,逐步實現(xiàn)全球同步注冊、 同步研發。 2017 年(nián) 6 月(yuè)國(guó)家(jiā)局加入 ICH 前, ICH 共發布了(le) 57 個(gè)指導 原則, 除《Q4B:藥典》和(hé)《Q6B:質量标準:生(shēng)物(wù)技(jì)術(shù)産品及生(shēng)物(wù) 制(zhì)品的(de)檢查方法及可(kě)接受标準》2 個(gè) ICH 指導原則将在 2025 年(nián)版《中國(guó)藥典》中逐步實施外(wài),其餘 55 個(gè) ICH 指導原則均以發布适用(yòng)公告、接受并翻譯指導原則原文(wén)的(de)形式實現(xiàn)充分(∑fēn)實施。加入 ICH 之後至2023 年(nián) 12 月(yuè), NMPA 積極選派專家(jiā)參與了(le)對(duì)舊(jiù)版 ICH 指導原則的(de)修訂或 增補的(de)國(guó)際協調工(gōng)作(zuò), 共計(jì) 13 個(gè), 并參與制(zhì)定新的(de) ICH 指導原則 11 個(gè), 國(guó)家(jiā)局均已原文(wén)采納、充分(fēn)實施。國(guó)家(jiā)局已'基本完成 ICH 當前 全部 68 個(gè)指導原則的(de)落地(dì)實施工(gōng)作(zuò), 這(zhè)為(wèi)中國(guó)患者可(kě)以及時(shí)分(f✔ēn)享全球藥物(wù)創新的(de)最新成果,用(yòng)上(shàng)放(fàng)心的(de)高(gāo)質量藥品奠定了(le)基礎。
二是(shì)全面參與 ICH 議(yì)題國(guó)際協調。截至 2023 年(nián) 12 月(yuè), ICH 正 在活躍的(de)協調議(yì)題共 32 個(gè)(詳見(jiàn)附件(jiàn) 9),其中涉及有(yǒu)效性(Efficacy) 指導原則 8 個(gè), 質量(Quality)指導原則 9 個(gè),安全性(Safety)指 導原則 2 個(gè),多(duō)學科(kē)(Multidiscipline)指導原則 10 個(gè), 另有(yǒu) 3 個(gè)討(tǎo) 論組。國(guó)家(jiā)局參與了(le)每個(gè) ICH 活躍議(yì)題的(de)技(jì)術(shù)討(tǎo)論和(hé)指導原則起草(cǎo) 工(gōng)作(zuò), 并在國(guó)際協調過程中積極分(fēn)享交流國(guó)內(nèi)監管經驗,了(le)解借鑒其 他(tā)監管機(jī)構監管良好(hǎo)實踐。例如(rú)在參與 ICH M13 口服速釋制(zhì)劑生(shēng)物(wù) 等效性系列指導原則的(de)協調過程中,結合中國(guó)豐富的(de)仿制(zhì)藥審評和(h≈é)監管經驗, 國(guó)家(jiā)局 ICH 專家(jiā)踴躍發言,及時(shí)提供案例支持。
三是(shì)緊跟國(guó)際學術(shù)前沿,及時(shí)引入轉化(huà) ICH 新理(lǐ)念、新方法、 新工(gōng)具、新标準。為(wèi)适應制(zhì)藥産業(yè)和(hé)先進制(zhì)造、納米藥物(wù)、人(ré₩n)工(gōng)智能(néng) 等領域新興技(jì)術(shù)的(de)發展趨勢, ICH 近(jìn)年(nián)來(lái)協調的(de)技(jì)術(shù)指南(nán)将對(duì)後續監 管理(lǐ)念和(hé)監管方式帶來(lái)調整。例如(rú)臨床試驗全球化(huàΩ)、新的(de)試驗設計(jì)和(hé) 新技(jì)術(shù)的(de)應用(yòng)推動了(le)藥物(wù)臨床×試驗質量管理(lǐ)規範(GCP)的(de)革新,ICH 正在修訂的(de) E6(R3)将提供更多(duō)的(de)靈活性,提高(gāo)患者參加臨床試驗的(de)便利性; 而 ICH 正在修訂的(de)《M4Q(R2):人(rén)用(yòng)藥品注冊通(tōng)用(yòng)技(jì)術(shù)文(wén)檔: 質量》指導原則,将對(duì)藥學注冊申報(bào)資•料的(de)文(wén)件(jiàn)格式和(hé)組織框架進行(xíng)重構,将為(wèi)監管機(jī)構和(hé)業(yè)界帶來(lái)一(yī)場(chǎng)變革。